
【题目】在100mL K2CO3与KAlO2的混合溶液中逐滴加入1mol·L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+离子的物质的量与加入盐酸溶液的体积变化关系,如图所示。下列说法正确的是

A. a点溶液中:c(HCO3-)+c(H2CO3)+c(H+)=c(OH-)
B. b点所得溶液中阴离子浓度大小顺序为:c(Cl-)>c(HCO3-)>c(CO32-)>c(OH-)
C. c点溶液中:c(Cl-)+c(HCO3-)+c(H2CO3)+c(CO32-)=1.5 mol·L-1
D. d→e的过程中水的电离程度逐渐减小
【答案】B
【解析】
第一阶段,在100mL K2CO3与KAlO2的混合溶液中逐滴加入1mol·L-1的盐酸,首先发生反应AlO2-+H++H2O═Al(OH)3↓,a点为K2CO3、KCl溶液;
第二阶段,AlO2-反应完毕,开始发生反应CO32-+H+═ HCO3-,b点CO32-、HCO3-的物质的量相等,但是水解程度不同,CO32-水解能力大于HCO3-。由图可知c点CO32-反应完毕,c点为KHCO3、KCl溶液;
第三阶段,cd段:CO32-反应完毕,然后发生反应HCO3-+H+═CO2↑+H2O,由图可知d点HCO3-反应完毕,d点为KCl溶液;
第四阶段,d→e的过程,发生反应Al(OH)3+3H+═Al3++3H2O,Al3+浓度逐渐增大,水的电离程度逐渐增大,据此进行解答。
A.由分析可知,a点为K2CO3、KCl溶液,根据质子守恒可得:(HCO3-)+2c(H2CO3)+c(H+)=c(OH-),故A错误;
B.b点K2CO3和KHCO3的浓度相等,加入了75mL盐酸,碳酸根离子的水解程度大于碳酸氢根离子,则c(HCO3-)>c(CO32-),所得溶液中阴离子浓度大小顺序为:c(Cl-)>c(HCO3-)>c(CO32-)>c(OH-),故B正确;
C. c点溶液中:c(Cl-)=![]() =0.5 mol·L-1,c(HCO3-)+c(H2CO3)+c(CO32-)=
=0.5 mol·L-1,c(HCO3-)+c(H2CO3)+c(CO32-)=![]() =0.25 mol·L-1,则c点溶液中:c(Cl-)+c(HCO3-)+c(H2CO3)+c(CO32-)=0.75 mol·L-1,故C错误;
=0.25 mol·L-1,则c点溶液中:c(Cl-)+c(HCO3-)+c(H2CO3)+c(CO32-)=0.75 mol·L-1,故C错误;
D.d→e的过程,发生反应Al(OH)3+3H+═Al3++3H2O,Al3+浓度逐渐增大,水的电离程度逐渐增大,故D错误;
答案选B。


 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:
【题目】四氢铝锂(LiAlH4)常作有机合成的重要还原剂。以辉锂矿(主要成分Li2OAl2O34SiO2,含少量Fe2O3)为原料合成四氢铝锂的流程如图:
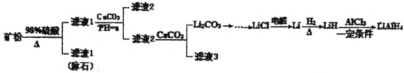
已知:①几种金属氢氧化物沉淀的pH如表所示:
物质 | Fe(OH)3 | A1(OH)3 |
开始沉淀的pH | 2.3 | 4.0 |
完全沉淀的pH | 3.7 | 6.5 |
②常温下,Ksp(Li2CO3)=2.0×10-3。Li2CO3在水中溶解度随着温度升高而减小。
回答下列问题:
(1)上述流程中,提高“酸浸”速率的措施有____ (写两条);加入CaCO3的作用是____,“a”的最小值为____。
(2)用热水洗涤Li2CO3固体,而不用冷水洗涤,其目的是___;检验碳酸锂是否洗净的实验操作是___。
(3)写出LiH和AlCl3反应的化学方程式:___(条件不作要求)
(4)设计简单方案由Li2CO3制备无水LiCl:___。
(5)在有机合成中,还原剂的还原能力通常用“有效氢”表示,其含义是1克还原剂相当于多少克氢气的还原能力,LiAlH4的“有效氢"为___。(结果保留2位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池是化学电源的雏形。关于如图所示原电池的说法正确的是
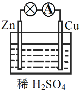
(1)如图连接好装置后,负极材料是__(填“Zn”或“Cu”),铜电极发生的现象:_____。
(2)相应原电池的总反应方程式为____。
(3)下列化学反应可通过原电池装置,可实现化学能直接转化为电能的是__(填序号)
①2NaOH+H2SO4=Na2SO4+2H2O
②Cu+2Fe3+=Cu2++2Fe2+
③C2H5OH+3O2![]() 2CO2+3H2O
2CO2+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA代表阿伏伽德罗常数的值。下列叙述正确的是
A. 用铅蓄电池电解氯化钠溶液得到标准状况下22.4L氢气时理论上铅蓄电池中消耗氢离子数目为4NA
B. 1L0.1mol·L-1NH4Cl溶液中含有的氮原子数小于0.1NA
C. 3.0g由葡萄糖和冰醋酸组成的混合物中含有的原子总数为0.3NA
D. 氢气与氯气反应生成标准状况下22.4L氯化氢,断裂化学键的总数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)![]() 2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量),根据如图可得出的判断结论正确的是
2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量),根据如图可得出的判断结论正确的是

A. a、b、c三个状态只有b是平衡状态
B. 达到平衡时A2的转化率大小为:b>a>c
C. 若T2<T1,则正反应一定是吸热反应
D. b点时,平衡体系中A、B原子数之比接近1∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氮及其化合物对化工生产有重要意义。
(1)已知:N2(g)+O2(g)=2NO(g); △H=+180 kJ·mol-1
4NH3(g)+5O2(g) =4NO(g)+6H2O(g); △H= -908 kJ·mol-1
请写出氨气被一氧化氮氧化生成无毒气体的热化学方程式:___________。
(2)工业合成氨的原理为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1。下图甲表示在一定体积的密闭容器中反应时N2的物质的量浓度随时间的变化,图乙表示在其他条件不变的情况下,改变起始投料中H2与N2的物质的量之比(设为k)对该平衡的影响。
2NH3(g) ΔH=-92.4 kJ·mol-1。下图甲表示在一定体积的密闭容器中反应时N2的物质的量浓度随时间的变化,图乙表示在其他条件不变的情况下,改变起始投料中H2与N2的物质的量之比(设为k)对该平衡的影响。

①已知图甲中0~t1 min内,v(H2)=0.03 mol·L-1·min-1,则t1=________ min;若从t2 min起仅改变一个反应条件,则所改变的条件可能是____________________________(填一种即可)。
②图乙中,b点时k=_________。
③已知某温度下该反应的平衡常数K=10,在该温度下向容器中同时加入下列浓度的混合气体:c(H2)=0.1 mol/L,c(N2)=0.5 mol/L,c(NH3)=0.1 mol/L,则在平衡建立过程中NH3的浓度变化趋势是__________(填“逐渐增大”“逐渐减小”或“恒定不变”)。
(3)联氨(又称肼,N2H4,无色液体)为二元弱碱,在水中的电离方式与氨相似,是一种应用广泛的化工原料,可用作火箭燃料。(已知:N2H4+H+![]() N2H5+)
N2H5+)
①N2H5+的电子式为_______。联氨与硫酸形成的酸式盐的化学式为________。
②联氨是一种常用的还原剂。向装有少量AgCl的试管中加入联氨溶液,观察到的现象___________________________________________________________。
(4)尿素(CO(NH2)2)是目前使用量较大的一种化学氮肥,工业上利用下图所示装置(阴、阳极均为惰性电极)电解尿素的碱性溶液制取氢气。
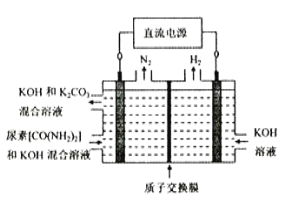
①该装置中阳极的总电极反应式为_____________________________________________。
②若两极共收集到气体22.4L(标准状况),则消耗的尿素为____________g(忽略气体的溶解)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如图。该电池工作时,下列说法正确的是( )
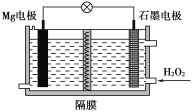
A.Mg电极是该电池的正极B.H2O2在石墨电极上发生氧化反应
C.石墨电极附近溶液的碱性增强D.溶液中Cl-向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含苯酚的工业废水的处理流程如图所示。

(1)①流程图设备Ⅰ中进行的是操作________(填写操作名称)。实验室里这一步操作可以用_______(填仪器名称)进行。
②由设备Ⅱ进入设备Ⅲ的物质A是______________(填化学式,下同)。由设备Ⅲ进入设备Ⅳ的物质B是___________。
③在设备Ⅲ中发生反应的化学方程式为_____________________。
④在设备Ⅳ中,物质B的水溶液和CaO反应后,产物是NaOH、H2O和______。通过 _________________(填操作名称)操作,可以使产物相互分离。
⑤图中,能循环使用的物质是_______、_____________C6H6和CaO。
(2)为了防止水源污染,用简单而又现象明显的方法检验某工厂排放的污水中有无苯酚,此方法是____________。
从废水中回收苯酚的方法是①用有机溶剂萃取废液中的苯酚;②加入某种药品的水溶液使苯酚与有机溶剂脱离;③加入某物质又析出苯酚。试写出②、③两步的反应方程式:_________________________。
(3)为测定废水中苯酚的含量,取此废水100 mL,向其中加入浓溴水至不再产生沉淀为止,得到沉淀0.331 g,求此废水中苯酚的含量____________(mg·L-1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有AlCl3和MgSO4混合溶液,向其中不断加入NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如图所示,求原溶液中Mg2+与Al3+的物质的量之比为( )

A.2:1B.6:1
C.1:2D.1:3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com