
����Ŀ��������ﮣ�LiAlH4�������л��ϳɵ���Ҫ��ԭ�����Ի�﮿���Ҫ�ɷ�Li2OAl2O34SiO2��������Fe2O3��Ϊԭ�Ϻϳ�������﮵�������ͼ��
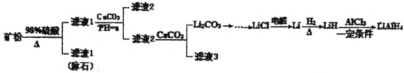
��֪���ټ��ֽ����������������pH�����ʾ��
���� | Fe(OH)3 | A1(OH)3 |
��ʼ������pH | 2.3 | 4.0 |
��ȫ������pH | 3.7 | 6.5 |
�ڳ����£�Ksp(Li2CO3)=2.0��10-3��Li2CO3��ˮ���ܽ�������¶����߶���С��
�ش��������⣺
��1�����������У��������������ʵĴ�ʩ��____ (д����)������CaCO3��������____����a������СֵΪ____��
��2������ˮϴ��Li2CO3���壬��������ˮϴ�ӣ���Ŀ����___������̼����Ƿ�ϴ����ʵ�������___��
��3��д��LiH��AlCl3��Ӧ�Ļ�ѧ����ʽ��___(��������Ҫ��)
��4����Ƽ�����Li2CO3�Ʊ���ˮLiCl��___��
��5�����л��ϳ��У���ԭ���Ļ�ԭ����ͨ��������Ч������ʾ���京����1�˻�ԭ���൱�ڶ��ٿ������Ļ�ԭ������LiAlH4������Ч��"Ϊ___��(�������2λС��)
���𰸡������ʯ�����ȡ��������Ũ�ȵ� ����pHʹAl3+��Fe3+ת������������ 6.5 ����̼��﮵���ʧ ȡ���һ��ϴ��Һ���Թ��У��μ��Ȼ�����Һ��ϡ���� AlCl3+4LiH=LiAlH4+3LiCl �������ܽ⣬���Ȼ���������������Һ 0.21
��������
��﮿�(��Ҫ�ɷ���Li2OAl2O34SiO2��������Fe2O3)Ϊԭ�Ϻϳ�������ﮣ�����м���Ũ����Ȼ����ˣ��õ�������1Ϊ��ʯ����Һ1�к�����������������������﮺����ᣬ����Һ1�м���̼��ƣ�̼��ƺ������ӷ�Ӧ�Ӷ�������Һ��pH��ʹ��Һ�������ӡ�������ת��Ϊ��������Һ2�к�������﮺�����ƣ�����Һ2�м���̼��ƣ��õ�̼��﮳�������Һ3������Ȼ�﮵õ�Li��Li���������ϵõ�LiH��LiH���Ȼ�����һ�������·�Ӧ����LiAlH4��
(1)������ӿ�ʯ�н�����������ʯ���������Ũ�ȡ����ȵȴ�ʩ������߷�Ӧ���ʣ�����̼����к���Һ�е��ᣬʹ������������ȫ�����������������������������Ӷ���ȥ���ʣ��ӱ�����Ϣ��������pH��СֵΪ6.5��ȷ����������ȫ������
(2)�����⣬̼��﮵��ܽ�����¶����߶���С������ˮϴ��̼��ﮣ����Լ���̼�����ʧ�����������������ƣ�����SO42-���жϳ����Ƿ�ϴ��������Ϊ��ȡ���һ��ϴ��Һ���Թ��У��μ��Ȼ�����Һ��ϡ����(������������)��
(3)�Ȼ������⻯﮷�Ӧ����������﮺��Ȼ�ﮣ�����ʽΪAlCl3+4LiH=LiAlH4+3LiCl��
(4)����ϡ�����ܽ�̼��﮵õ��Ȼ�ﮣ���Ϊ�Ȼ��ˮ�⣬Ϊ��ֹ��ˮ�⣬��Ҫ���Ȼ����������Ȼ����Һ���Ӷ��õ�LiCl���壻
(5)�������Ϣ��֪����ԭ���Ļ�ԭ����ʵָʧ��������1molLiAlH4���ṩ8mol���ӣ��൱��4molH2��LiAH4����Ч��Ϊ![]() ��0.21��
��0.21��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ij���巴Ӧ��ƽ�ⳣ���ɱ�ʾΪK=c(CH3OCH3)c(H2O)/c2(CH3OH)���÷�Ӧ�ڲ�ͬ�¶��µ�ƽ�ⳣ����400����K=32��500����K=44����ش��������⣺
��1��д��������Ӧ�Ļ�ѧ����ʽ��_________________________________ ��
��2���÷�Ӧ����H _________0��
��3����֪���ܱ������У����ijʱ�̸���ֵ�Ũ�����£�
���� | CH3OH(g�� | CH3OCH3(g�� | H2O(g�� |
Ũ��/��molL-1�� | 0.54 | 0.68 | 0.68 |
�ٴ�ʱ�¶�400�棬��ijʱ������_______���������������ͬ����
�������¶�Ϊ�����꣬�Ը��¶���ƽ��̬�״����ʵ���nΪ�����꣬��ʱ��Ӧ����ͼ���λ����ͼ��____�㣬�Ƚ�ͼ��B��D��������Ӧ������Ӧ������B_______��D��������____��

��4��һ��������Ҫ��߷�Ӧ���ת���ʣ����Բ��õĴ�ʩ��___________��
a�������¶� b��������� c��ѹ�����������
d������ˮ������Ũ�� e����ʱ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�������ʳƷ������Ӫ��Υ�����ӷ�ʳ�����ʡ�����ʳƷ���Ӽ�����������ũҵ���Ȳ������Ϲ����˰��������������ڵ�22����������ʳƷ���Ӽ���������ijͬѧΪ̽���������������ұ���ʱ��ϳ���ʳƷ��������������ʵ�鷽����
![]()
(1)�Լ�1����Ҫ�ɷֵĻ�ѧʽ��________��
(2)����������ˮ����Һ��ɫ�����ԭ����_____________(�����ӷ���ʽ��ʾ)��
(3)��ͬѧ��ʵ���м����˹�����ˮ������һ��ʱ��������ɫ��ȥ���ֶ���ɫԭ�����̽����
���������
����1����Һ�еģ�3����������Ϊ����̬������
����2��___________��
����Ʒ���
Ϊ�˶���������ļ���2������֤����д��һ��ʵ�鷽����_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��������̼����ϡ����������ɵ�ԭ���װ�ã�c��dΪ�����缫�������йص��ж���ȷ����

A.��ع����Ĺ����У�c�缫�ϲ�������
B.��ع���ʱ����Һ��H+��Fe2+��d�ƶ�
C.dΪ����������������Ӧ
D.��ع����Ĺ����У���Һ��SO![]() Ũ�ȷ��������仯
Ũ�ȷ��������仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ����д���пհף�
(1)д����ʾ����8�����ӡ�10�����ӵ�ԭ�ӵĻ�ѧ���ţ�__________��
(2)���ڱ�������õķǽ���Ԫ��λ�ڵ�__________���С�
(3)���ڱ���λ�ڵ�4���ڡ���A���Ԫ�ط����ǣ�___________ ��
(4)����Ԫ��Ϊ18�ֵ������ǵ�_________���ڡ���________���ڡ�
(5)д����2���ڡ���A��Ԫ�ص��ʵĵ���ʽ��______________ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ѵĵ��ұ��������ͼ��ʾ���Ժ�����CaC12��CaO��������Ϊ���ʣ����ʱ�������ɵ�Ca��һ����ԭTiO2�õ��ѡ�����˵������ȷ����
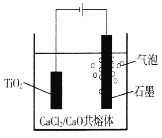
A. Ca��ԭTiO2�Ļ�ѧ����ʽΪ2Ca+TiO2===Ti+2CaO
B. ����ʯī�ȶ���ǿ����ʵ������������������������ı�
C. CaC12�����ÿ�������ǿ�����ԣ�ͬʱ�����ۼ�������
D. ��֪F=96500C��mol-1����I=0.5A��ͨ��80���ӣ������Ͽɵ�Ti������Ϊ(0.5��80��60��48)/4��96500g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���һ�������0.1mol��L-1��Na2CO3��Һ����μ���0.1mol��L-1��������������Һ�к�̼Ԫ�صĸ��������ʵ���Ũ�ȵİٷֺ�������ҺpH�ı仯��ͼ��ʾ��CO2���ݳ�δ�������μ�����Ĺ������¶ȵı仯���Բ��ƣ�������˵����ȷ����
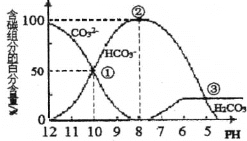
A. ��ͼ��֪��̼���-lgKa2=10
B. �����ʾ��Һ�У�c(HCO3-)=0.1mol��L-1
C. ���μ����ᵽ���ʱ���ſ�ʼ�ų�CO2����
D. Na2CO3��һ��ˮ�ⷴӦ��ƽ�ⳣ�����٣��ڣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪Ksp(AgCl)��1.56��10��10��Ksp(AgBr)��7.7��10��13��Ksp(Ag2CrO4)��9.0��10��12������˵����ȷ����(����)
A. ����Ũ�Ⱦ�Ϊ0.010 mol��L��1��Cl����Br����Һ����μ���0.010 mol��L��1��AgNO3��Һʱ���Ȳ�������������ΪCl��
B. ��AgClˮ��Һ�м���Ũ���ᣬKspֵ���
C. ��AgCl����Һ�м�������KBr��Һ���������ɰ�ɫת��Ϊ����ɫ
D. �ɷ���ʽ��Ag2CrO4(s)![]() 2Ag��(aq)��CrO42-(aq)������֪Ag2CrO4�ı�����Һһ����2c(Ag��)��c(CrO42-)
2Ag��(aq)��CrO42-(aq)������֪Ag2CrO4�ı�����Һһ����2c(Ag��)��c(CrO42-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����100mL K2CO3��KAlO2�Ļ����Һ����μ���1mol��L-1�����ᣬ�����Һ�е�CO32-��HCO3-��AlO2-��Al3+���ӵ����ʵ��������������Һ������仯��ϵ����ͼ��ʾ������˵����ȷ����

A. a����Һ�У�c(HCO3-)+c(H2CO3)+c(H+)=c(OH-)
B. b��������Һ��������Ũ�ȴ�С˳��Ϊ��c(Cl-)>c(HCO3-)>c(CO32-)>c(OH-)
C. c����Һ�У�c(Cl-)+c(HCO3-)+c(H2CO3)+c(CO32-)=1.5 mol��L-1
D. d��e�Ĺ�����ˮ�ĵ���̶���С
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com