
【题目】室温下,向一定体积的0.1mol·L-1的Na2CO3溶液中逐滴加入0.1mol·L-1盐酸至过量,溶液中含碳元素的各微粒的物质的量浓度的百分含量随溶液pH的变化如图所示(CO2因逸出未画出,滴加盐酸的过程中温度的变化忽略不计)。下列说法正确的是
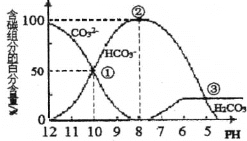
A. 由图可知,碳酸的-lgKa2=10
B. 点②所示溶液中:c(HCO3-)=0.1mol·L-1
C. 当滴加盐酸到点③时,才开始放出CO2气体
D. Na2CO3第一步水解反应的平衡常数:①>②>③
【答案】A
【解析】
A.已知HCO3-![]() CO32-+H+,当pH=10,即c(H+)=10-10mol/L时,c(HCO3-)=c(CO32-),此时Ka2=
CO32-+H+,当pH=10,即c(H+)=10-10mol/L时,c(HCO3-)=c(CO32-),此时Ka2=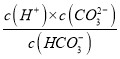 =c(H+)=10-10mol/L,则碳酸的-lgKa2=10,故A正确;
=c(H+)=10-10mol/L,则碳酸的-lgKa2=10,故A正确;
B.点②所示溶液中含C元素的微粒有HCO3-、CO32-,且滴加盐酸后溶液体积增大,物料守恒可知,c(HCO3-)+c(CO32-)<0.1mol/L,故B错误;
C.图象可知PH≤6时,H2CO3的量保持不变,说明PH=6时,二氧化碳在溶液中已达到饱和,之后就会有二氧化碳气体放出,故C错误;
D.平衡常数只随温度变化,温度不变平衡常数不变,Na2CO3第一步水解反应的平衡常数:①=②=③,故D错误;
故答案为A。


科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列说法错误的是
A. PM2.5是指粒径不大于2.5μm的可吸入悬浮颗粒物
B. 绿色化学要求从源头上消除或减少生产活动对环境的污染
C. 燃煤中加入CaO可以减少酸雨的形成及温室气体的排放
D. 天然气和液化石油气是我国目前推广使用的清洁燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应的热效应只与反应物的初始状态和生成物的最终状态有关,下列各反应热关系中不正确的是( )

A. A→F ΔH=-ΔH6
B. A→D ΔH=ΔH1+ΔH2+ΔH3
C. ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6=0
D. ΔH1+ΔH6=ΔH2+ΔH3+ΔH4+ΔH5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氢铝锂(LiAlH4)常作有机合成的重要还原剂。以辉锂矿(主要成分Li2OAl2O34SiO2,含少量Fe2O3)为原料合成四氢铝锂的流程如图:
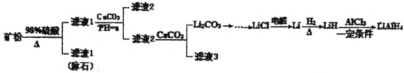
已知:①几种金属氢氧化物沉淀的pH如表所示:
物质 | Fe(OH)3 | A1(OH)3 |
开始沉淀的pH | 2.3 | 4.0 |
完全沉淀的pH | 3.7 | 6.5 |
②常温下,Ksp(Li2CO3)=2.0×10-3。Li2CO3在水中溶解度随着温度升高而减小。
回答下列问题:
(1)上述流程中,提高“酸浸”速率的措施有____ (写两条);加入CaCO3的作用是____,“a”的最小值为____。
(2)用热水洗涤Li2CO3固体,而不用冷水洗涤,其目的是___;检验碳酸锂是否洗净的实验操作是___。
(3)写出LiH和AlCl3反应的化学方程式:___(条件不作要求)
(4)设计简单方案由Li2CO3制备无水LiCl:___。
(5)在有机合成中,还原剂的还原能力通常用“有效氢”表示,其含义是1克还原剂相当于多少克氢气的还原能力,LiAlH4的“有效氢"为___。(结果保留2位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下向100mL 0.2mol·L-1的氨水中逐滴加入0.2mol·L-1的盐酸,所得溶液的pH、溶液中NH4+和NH3·H2O的物质的量分数![]() 与加入盐酸的体积V的关系如图所示,下列说法错误的是
与加入盐酸的体积V的关系如图所示,下列说法错误的是
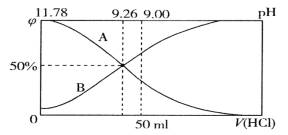
A. 表示NH3·H2O物质的量分数变化的曲线是A
B. NH3·H2O的电离常数为1.8×10-5mol·L-1(已知lg1.8=0.26)
C. 当加入盐酸体积为50mL时,溶液中c(NH4+)-c(NH3·H2O)=2×(10-5-10-9)mol·L-1
D. pH=9.26时的溶液中,NH4+的水解程度等于NH3·H2O的电离程度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D原子序数依次递增的短周期主族元素,常温常压下AB2是一种红棕色气体,B与C同主族,则:
(1)C元素在周期表中的位置____________。
(2)画出D元素的简单离子结构示意图_______________________。
(3)将CB2与D2以体积比1:1混合后通入品红溶液中,品红溶液不褪色,请用一个化学方程式来解释:_________________________________。
(4)AB2与水反应的化学方程式为___________,在一定温度和压强下,将一个容积为15mL的试管充满AB2后,倒置于一个盛水的水槽中,当试管液面上升至一定高度不再变化时,相同条件下再通入O2,若要使试管液面仍保持在原高度,则应通入的O2为___________mL。
(5)甲、乙、丙均为含A元素的化合物,丁为单质,甲、乙、丙、丁四种物质有如下转化关系(反应条件及部分产物已略去)
![]()
①若丁为一种常见的非金属单质,甲为氢化物,乙为氧化物,则一个乙分子所含有的电子数目___________。
②若丁为一种常见的金属单质,常温下丁在甲的浓溶液中能反应但很快停止,则丙的化学式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ(1)H2S与CO2在高温下发生反应:H2S(g)+CO2(g)![]() COS(g) +H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。则H2S的平衡转化率为______%,反应平衡常数K=________。
COS(g) +H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。则H2S的平衡转化率为______%,反应平衡常数K=________。
(2)已知25℃,NH3·H2O的Kb=1.8×105,H2SO3的Ka1=1.3×102,Ka2=6.2×108。若氨水的浓度为2.0 mol·L1,溶液中的c(OH)=_______mol·L1,0.1 mol·L1的(NH4)2SO3溶液显______(填“酸性”、“碱性”或“中性”)。
Ⅱ. 某学生用0.200mol/L的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
①用蒸馏水洗涤碱式滴定管,并注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线稍下,并记下读数
④量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数
请回答:
(1)以上步骤有错误的是______ (填编号)。
(2)用标准NaOH溶液滴定时,应将标准NaOH溶液注入______ 中(从图中选填“甲”或“乙”)。

(3)下列操作会引起实验结果偏大的是:______![]() 填编号
填编号![]() 。
。
A. 在锥形瓶装液前,留有少量蒸馏水
B. 滴定前,滴定管尖嘴有气泡,滴定后无气泡
C. 滴定终点俯视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池是化学电源的雏形。关于如图所示原电池的说法正确的是
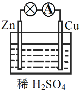
(1)如图连接好装置后,负极材料是__(填“Zn”或“Cu”),铜电极发生的现象:_____。
(2)相应原电池的总反应方程式为____。
(3)下列化学反应可通过原电池装置,可实现化学能直接转化为电能的是__(填序号)
①2NaOH+H2SO4=Na2SO4+2H2O
②Cu+2Fe3+=Cu2++2Fe2+
③C2H5OH+3O2![]() 2CO2+3H2O
2CO2+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如图。该电池工作时,下列说法正确的是( )
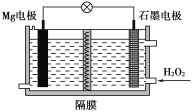
A.Mg电极是该电池的正极B.H2O2在石墨电极上发生氧化反应
C.石墨电极附近溶液的碱性增强D.溶液中Cl-向正极移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com