
【题目】常温下向100mL 0.2mol·L-1的氨水中逐滴加入0.2mol·L-1的盐酸,所得溶液的pH、溶液中NH4+和NH3·H2O的物质的量分数![]() 与加入盐酸的体积V的关系如图所示,下列说法错误的是
与加入盐酸的体积V的关系如图所示,下列说法错误的是
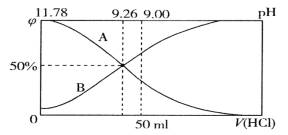
A. 表示NH3·H2O物质的量分数变化的曲线是A
B. NH3·H2O的电离常数为1.8×10-5mol·L-1(已知lg1.8=0.26)
C. 当加入盐酸体积为50mL时,溶液中c(NH4+)-c(NH3·H2O)=2×(10-5-10-9)mol·L-1
D. pH=9.26时的溶液中,NH4+的水解程度等于NH3·H2O的电离程度
【答案】D
【解析】
A.氨水与盐酸反应生成氯化铵,随加入盐酸体枳的增大,NH4+的物质的量增大、NH3·H2O的物质的量减小,表示NH3·H2O物质的量分数变化的曲线是A,故A正确;
B.根据图象,![]() 时,PH=9.26,
时,PH=9.26,![]() ,故B正确;
,故B正确;
C. 当加入盐酸体积为50mL时,氨水剩余一半,溶质为等浓度的氯化铵和NH3·H2O,此时溶液pH=9,根据电荷守恒c(NH4+)+ c(H+)= c(Cl-)+ c(OH-),根据物料守恒c(NH4+)+c(NH3·H2O)=2 c(Cl-),所以c(NH4+)+ 2c(H+)= c(NH3·H2O)+ 2c(OH-) , c(NH4+)-c(NH3·H2O)= 2c(OH-)-2c(H+)=2×10-5-2×10-9,故C正确;
D. pH=9.26时的溶液中,NH4+的浓度等于NH3·H2O的浓度,但水解和电离程度不同,故D错误,答案选D。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】有关电化学知识的描述正确的是
A. Cu+H2SO4=CuSO4+H2↑这个反应可设计成原电池
B. 利用Cu+2FeCl3=CuCl2+2FeCl2,可设计如图所示原电池装置,盐桥内K+向FeCl3溶液移动

C. 因为铁的活泼性强于铜,所以将铁、铜用导线连接后放入浓硝酸中组成原电池,铁作负极,铜作正极,其负极反应式为Fe-2e-=Fe2+
D. 由Al、Mg与氢氧化钠溶液组成的原电池,其负极反应式为Mg-2e-+2OH-=Mg(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)甲醛的电子式:____________________。
(2)2,5-二甲基-2,4-己二烯的结构简式______________________________。
(3)![]() 的键线式为________________________。
的键线式为________________________。
(4)写出分子式为C4H9Cl的所有同分异构体中核磁共振氢谱只有一组峰的结构简式_______________。
(5)![]() 中含氧官能团的名称是______________________。
中含氧官能团的名称是______________________。
(6)用系统命名法命名下列有机物:
①![]() ______________________。
______________________。
②![]() ______________________。
______________________。
③![]() ______________________。
______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填写下列空白:
(1)写出表示含有8个质子、10个中子的原子的化学符号:__________。
(2)周期表中最活泼的非金属元素位于第__________纵行。
(3)周期表中位于第4周期、ⅡA族的元素符号是:___________ 。
(4)所含元素为18种的周期是第_________周期、第________周期。
(5)写出第2周期、ⅤA族元素单质的电子式:______________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L密闭容器中,800 ℃时,反应2NO+O2![]() 2NO2体系中,n(NO)随时间的变化如下表:
2NO2体系中,n(NO)随时间的变化如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)如图表示各物质浓度的变化曲线,
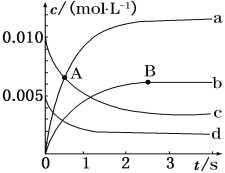
A点处,v(正)___________v(逆), A点正反应速率_________B点正反应速率。 (用“大于”、“小于”或“等于”填空)
(2)图中表示O2变化的曲线是___________。用NO2表示从0~2 s内该反应的平均速率v=____________________________。
(3) 能使该反应的反应速率增大的是____________。
A.及时分离出NO2气体 B.升高温度
C.减小O2的浓度 D.选择高效的催化剂
(4) 能说明该反应已经达到平衡状态的是___________。
A.容器内压强保持不变 B.v(NO)=2v(O2)
C.容器内的密度保持不变 D.v逆(NO2)=2v正(O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向一定体积的0.1mol·L-1的Na2CO3溶液中逐滴加入0.1mol·L-1盐酸至过量,溶液中含碳元素的各微粒的物质的量浓度的百分含量随溶液pH的变化如图所示(CO2因逸出未画出,滴加盐酸的过程中温度的变化忽略不计)。下列说法正确的是
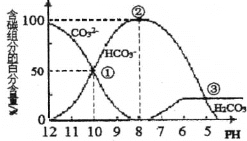
A. 由图可知,碳酸的-lgKa2=10
B. 点②所示溶液中:c(HCO3-)=0.1mol·L-1
C. 当滴加盐酸到点③时,才开始放出CO2气体
D. Na2CO3第一步水解反应的平衡常数:①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示A处通入潮湿的Cl2,关闭活塞B时D中干燥的红色布条颜色无变化;打开活塞B时D处干燥的红色布条褪色,则C中的试剂(足量)不可能是
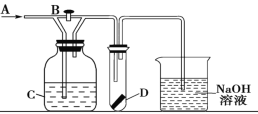
A.饱和氯化钠溶液B.氢氧化钙悬浊液C.饱和碳酸钠溶液D.浓硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在硫酸铜晶体结晶水含量测定的实验中,会造成实验结果偏低的是( )
A. 加热时间过长,固体部分变黑B. 坩埚内附有不挥发杂质
C. 晶体不纯,含有不挥发杂质D. 加热过程中有少量晶体溅出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温、恒容的密闭容器中进行反应 A(g)═B(g)+C(g),若反应物的浓度由2molL-1 降到 0.8molL-1 需要 20s,那么反应物浓度再由 0.8molL-1 降到 0.2molL-1 所需要的时间为
A.10sB.大于 10sC.小于 10sD.无法判断
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com