
【题目】在2 L密闭容器中,800 ℃时,反应2NO+O2![]() 2NO2体系中,n(NO)随时间的变化如下表:
2NO2体系中,n(NO)随时间的变化如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)如图表示各物质浓度的变化曲线,
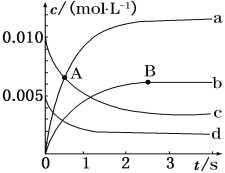
A点处,v(正)___________v(逆), A点正反应速率_________B点正反应速率。 (用“大于”、“小于”或“等于”填空)
(2)图中表示O2变化的曲线是___________。用NO2表示从0~2 s内该反应的平均速率v=____________________________。
(3) 能使该反应的反应速率增大的是____________。
A.及时分离出NO2气体 B.升高温度
C.减小O2的浓度 D.选择高效的催化剂
(4) 能说明该反应已经达到平衡状态的是___________。
A.容器内压强保持不变 B.v(NO)=2v(O2)
C.容器内的密度保持不变 D.v逆(NO2)=2v正(O2)
【答案】大于 大于 d 0.003 mol·L-1·s-1 BD AD
【解析】
(1)A点后c浓度继续减小,a的浓度继续增大,故A点向正反应进行,正反应速率继续减小、逆反应速率继续增大到平衡状态B点时正、逆速率相等;
由表中数据可知从3s开始,NO的物质的量为0.007mol,不再变化,3s时反应达平衡;
(2)氧气是反应物,随反应进行浓度减小,由方程式可知2△c(O2)=△c(NO);
根据v= ![]() ,计算v(NO),再利用速率之比等于化学计量数之比计算v(NO2);
,计算v(NO),再利用速率之比等于化学计量数之比计算v(NO2);
(3)升高温度、使用催化剂、增大反应物浓度都可能加快反应速率,减低浓度反应速率会减慢.
(4)可逆反应达到平衡时,v正=v逆 (同种物质表示)或正、逆速率之比等于化学计量数之比(不同物质表示),反应混合物各组分的物质的量、浓度、含量不再变化,以及由此衍生的一些量也不发生变化,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
(1)A点后c浓度继续减小,a的浓度继续增大,故A点向正反应进行,则v(正)>v(逆);而B点处于平衡状态,即v(正)=v(逆),A点正反应速率继续减小、逆反应速率继续增大到平衡状态B点,A点正反应速率>B点正反应速率;
答案为大于;大于;
(2)氧气是反应物,随反应进行浓度减小,由方程式可知2△c(O2)=△c(NO),由图可知曲线c的浓度变化为曲线d的2倍,故曲线c表示NO,曲线d表示氧气;
2s内用NO表示的平均反应速率v(NO)= 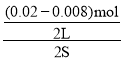 =0.003molL1s1,速率之比等于化学计量数之比,所以v(NO2)=v(NO)=0.003molL1s1;
=0.003molL1s1,速率之比等于化学计量数之比,所以v(NO2)=v(NO)=0.003molL1s1;
答案为d;0.003molL1s1;
(3)
A.及时分离出NO2气体,会使NO2气体浓度降低,反应速率减慢,故A错误;
B.升高温度反应速率加快,故B正确;
C.减少O2的浓度,反应速率减慢,故C错误;
D.选择高效的催化剂,加快反应速率,故D正确;
答案选BD。.
(4)
A.随反应进行,反应混合气体总的物质的量在减小,恒温恒容下容器内压强减小,容器内压强不再变化说明反应到达平衡,故A正确;
B.若表示同一方向反应速率,v(NO)自始至终为v(O2)的2倍,不能说明达到平衡,故B错误;
C.混合气体的总质量不变,容器容积不变,所以密度自始至终不变,不能说明达到平衡,故C错误;
D.由方程式可知v正(NO2)=2v正(O2),而v逆(NO2)=2v正(O2),故v逆(NO2)=v正(NO2),反应到达平衡,故D正确;
答案选AD


科目:高中化学 来源: 题型:
【题目】化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的,如下图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化。则下列说法正确的是

A. 通常情况下,NO比N2稳定
B. 通常情况下,N2(g)和O2(g)混合能直接生成NO
C. 1molN2(g)和1molO2(g)具有的总能量小于2mol NO(g)具有的总能量
D. 1molN2(g)和1molO2(g)反应放出的能量为180kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于各图的说法中正确的是
A.  ①中阳极处能产生使湿润淀粉-KI试纸变蓝的气体
①中阳极处能产生使湿润淀粉-KI试纸变蓝的气体
B.  ②中待镀铁制品应与电源正极相连
②中待镀铁制品应与电源正极相连
C.  ③中钢闸门应与外接电源的负极相连,称为牺牲阳极的阴极保护法
③中钢闸门应与外接电源的负极相连,称为牺牲阳极的阴极保护法
D.  ④中离子交换膜可以避免生成的Cl2与NaOH溶液反应
④中离子交换膜可以避免生成的Cl2与NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下的密闭容器中:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH=-905.9 kJ/mol,下列叙述正确的是( )
4NO(g)+6H2O(g) ΔH=-905.9 kJ/mol,下列叙述正确的是( )
A. 4 mol NH3和5 mol O2反应,达到平衡时放出的热量为905.9 kJ
B. 平衡时5v正(O2)= 4v逆(NO)
C. 平衡后增大压强,混合气体的平均摩尔质量增大
D. 平衡后升高温度,混合气体中NO含量增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中,甲是电解饱和食盐水,乙是铜的电解精炼,丙是电镀,回答:

(1)b极上的电极反应式为__,甲电池的总反应化学方程式是__。
(2)在粗铜的电解过程中,图中c电极的材料是__(填“粗铜板”或“纯铜板”);在d电极上发生的电极反应为__;若粗铜中还含有Au、Ag、Fe等杂质,则沉积在电解槽底部(阳极泥)的杂质是__,电解一段时间后,电解液中的金属离子有__。
(3)如果要在铁制品上镀镍(二价金属,相对原子质量59),则f电极的材料是__(填“铁制品”或“镍块”,下同),e电极的材料是__。
(4)若e电极的质量变化118 g,则a电极上产生的气体在标准状况下的体积为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下向100mL 0.2mol·L-1的氨水中逐滴加入0.2mol·L-1的盐酸,所得溶液的pH、溶液中NH4+和NH3·H2O的物质的量分数![]() 与加入盐酸的体积V的关系如图所示,下列说法错误的是
与加入盐酸的体积V的关系如图所示,下列说法错误的是
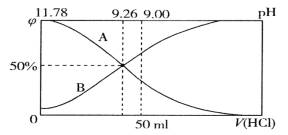
A. 表示NH3·H2O物质的量分数变化的曲线是A
B. NH3·H2O的电离常数为1.8×10-5mol·L-1(已知lg1.8=0.26)
C. 当加入盐酸体积为50mL时,溶液中c(NH4+)-c(NH3·H2O)=2×(10-5-10-9)mol·L-1
D. pH=9.26时的溶液中,NH4+的水解程度等于NH3·H2O的电离程度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是一种常用的化工原料。
Ⅰ.以CO2与NH3为原料可以合成尿素[CO(NH2)2]。合成尿素的反应为2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g)。
CO(NH2)2(s)+H2O(g)。
(1)在不同温度及不同y值下合成尿素,达到平衡时,氨气转化率变化情况如图所示。该反应的ΔH_____0(填“>”、“<”或“=”,下同),若y表示压强,则y1_______y2 , 若y表示反应开始时的水碳比[n(NH3)/n(CO2)],则y1_______y2。

(2)t℃时,若向容积为2L的密闭容器中加入3molNH3和1molCO2,达到平衡时,容器内压强为开始时的0.75倍。若保持条件不变,再向该容器中加入0.5molCO2和1molH2O,NH3的转化率将__________(填“增大”、“减小”或“不变”)。
Ⅱ.CO2与H2反应可用于生产甲醇。
(3)已知氢气与甲醇的燃烧热分别为-285.8 kJ·mol-1、-726.5kJ·mol-1,则CO2与H2反应产生液态甲醇与液态水的热化学方程式为________________。
(4)下图是某甲醇燃料电池工作的示意图。质子交换膜(只有质子能够通过)左右两侧的溶液均为1L 2mol·L-1 H2SO4溶液。电极a上发生的电极反应式为________________________,当电池中有1mol e-发生转移时左右两侧溶液的质量之差为______g (假设反应物耗尽,忽略气体的溶解)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),H=-akJmol-1,在5L密闭容器投入1molNH3和1mol的O2,2分钟后NO的物质的量增加了0.4mol,下列说法正确的是( )
4NO(g)+6H2O(g),H=-akJmol-1,在5L密闭容器投入1molNH3和1mol的O2,2分钟后NO的物质的量增加了0.4mol,下列说法正确的是( )
A.2分钟反应放出的热量值小于0.1akJ
B.用氧气表示0~2min的反应速率:v(O2)=0.05mol·L-1·min-1
C.2分钟内NH3的转化率是50%
D.2分钟末c(H2O)=0.6mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证卤素单质氧化性的相对强弱,某学习小组用如图所示装置进行实验(夹持仪器已略去,气密性已检验).

实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸.
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹.
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a.
Ⅳ.
(1)A中产生黄绿色气体,其电子式是 ______;A中使用KMnO4可以在不加热的情况下与浓盐酸发生反应。如果改用二氧化锰,则在加热条件下发生的化学反应方程式为______。
(2)验证氯气的氧化性强于碘的实验现象是 ______ 。
(3)B中溶液发生反应的离子方程式是 ______ 。
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是 ______。
(5)过程Ⅲ实验的目的是 ______ 。
(6)实验结论:氯、溴、碘单质的氧化性逐渐 ______ ,原因是:同主族元素从上到下 ______ ,得电子能力逐渐 ______ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com