
【题目】下列关于各图的说法中正确的是
A.  ①中阳极处能产生使湿润淀粉-KI试纸变蓝的气体
①中阳极处能产生使湿润淀粉-KI试纸变蓝的气体
B.  ②中待镀铁制品应与电源正极相连
②中待镀铁制品应与电源正极相连
C.  ③中钢闸门应与外接电源的负极相连,称为牺牲阳极的阴极保护法
③中钢闸门应与外接电源的负极相连,称为牺牲阳极的阴极保护法
D.  ④中离子交换膜可以避免生成的Cl2与NaOH溶液反应
④中离子交换膜可以避免生成的Cl2与NaOH溶液反应
【答案】D
【解析】
A.①装置是电解池,铁是活泼金属作阳极,由于阳极上是活性电极,故Cl-不放电,即阳极不能生成氯气,湿润淀粉-KI试纸不会变蓝色,A错误;
B.②装置中待镀制品上要有Cu2+放电析出铜,镀件应和电源负极相连,作电解池的阴极,B错误;
C.③装置是电解池,为了保护钢铁闸门不被腐蚀,要与外接电源的负极连接,作阴极,因此该方法叫外接电源的阴极保护法,C错误;
D. Cl2与水反应产生酸性物质,能和NaOH在溶液中反应反应。而Cl2在阳极生成,NaOH在阴极生成,④装置中的离子交换膜只允许Na+等阳离子通过,Cl2分子不能通过,就可以避免生成的Cl2与NaOH溶液反应,D正确;
故合理选项是D。


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】对于敞口容器中的化学反应:Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g),下列叙述中不正确的是( )

A. Zn和H2SO4的总能量大于ZnSO4和H2的总能量
B. 反应过程中能量关系可用上图表示
C. 若将该反应设计成原电池,则Zn为负极
D. 若将该反应设计成原电池,当有32.5g锌溶解时正极放出22.4 L气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒压下,向密闭容器中充入4 mol SO2和2 mol O2,发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0,2min后,反应达到平衡,生成SO3为1.4 mol,同时放出热量Q kJ。则下列分析正确的是( )
2SO3(g) ΔH<0,2min后,反应达到平衡,生成SO3为1.4 mol,同时放出热量Q kJ。则下列分析正确的是( )
A. 在该条件下,反应前后的压强之比为6∶5.3
B. 若反应开始时容器体积为2 L,则v(SO3)=0.35 mol/(L·min)
C. 若把“恒温恒压下”改为“恒压绝热条件下”反应,平衡后n(SO3)<1.4 mol
D. 若把“恒温恒压下”改为“恒温恒容下”反应,达平衡时放出热量大于Q kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某温度时,将n mol/L的氨水滴入10 mL1.0 mol/L盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示,下列有关说法正确的是

A. a点KW=1.0×10-14
B. 水的电离程度:b﹥a﹥c﹥d
C. b点:c(NH4+)﹥c(Cl-)﹥c(H+)﹥c(OH-)
D. 25℃时NH4Cl水解平衡常数为(n-1)×10-7(用n表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员研制出一种室温Na-CO2电池。该电池吸收CO2的工作原理如图所示。吸收的全部CO2中,有![]() 转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面。下列说法不正确的是
转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面。下列说法不正确的是
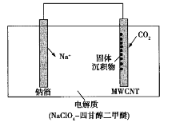
A. 钠箔为负极,发生氧化反应
B. 每吸收22.4 LCO2,转移电子数为![]() mol
mol
C. 正极反应式:4Na++3CO2+4e-=2Na2CO3+C
D. Na+通过电解质移向MWCNT极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)甲醛的电子式:____________________。
(2)2,5-二甲基-2,4-己二烯的结构简式______________________________。
(3)![]() 的键线式为________________________。
的键线式为________________________。
(4)写出分子式为C4H9Cl的所有同分异构体中核磁共振氢谱只有一组峰的结构简式_______________。
(5)![]() 中含氧官能团的名称是______________________。
中含氧官能团的名称是______________________。
(6)用系统命名法命名下列有机物:
①![]() ______________________。
______________________。
②![]() ______________________。
______________________。
③![]() ______________________。
______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种Cu-Li可充电电池的工作原理如图所示,其中非水系电解液和水系电解液被锂离子固体电解质陶瓷片(LISICON)隔开。下列说法正确的是
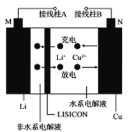
A. 陶瓷片允许水分子通过
B. 电池放电时,N极上发生氧化反应
C. 电池充电时,接线柱B应与外接直流电源的正极相连
D. 电池充电时,阳极反应为Li++e-=Li
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L密闭容器中,800 ℃时,反应2NO+O2![]() 2NO2体系中,n(NO)随时间的变化如下表:
2NO2体系中,n(NO)随时间的变化如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)如图表示各物质浓度的变化曲线,
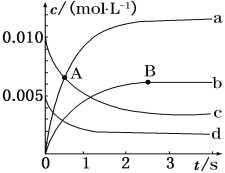
A点处,v(正)___________v(逆), A点正反应速率_________B点正反应速率。 (用“大于”、“小于”或“等于”填空)
(2)图中表示O2变化的曲线是___________。用NO2表示从0~2 s内该反应的平均速率v=____________________________。
(3) 能使该反应的反应速率增大的是____________。
A.及时分离出NO2气体 B.升高温度
C.减小O2的浓度 D.选择高效的催化剂
(4) 能说明该反应已经达到平衡状态的是___________。
A.容器内压强保持不变 B.v(NO)=2v(O2)
C.容器内的密度保持不变 D.v逆(NO2)=2v正(O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某个体小煤矿曾发生瓦斯爆炸事故,造成人员伤亡。在煤矿矿井里,必须采取安全措施,如通风、严禁烟火等,而且要随时检查瓦斯的体积分数,如果空气中含甲烷的体积分数为5%~15.4%,遇到明火会发生爆炸。发生最强烈爆炸时空气中甲烷所占的体积分数约是
A. 5% B. 9.1% C. 10.5% D. 15%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com