
【题目】Ⅰ(1)H2S与CO2在高温下发生反应:H2S(g)+CO2(g)![]() COS(g) +H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。则H2S的平衡转化率为______%,反应平衡常数K=________。
COS(g) +H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。则H2S的平衡转化率为______%,反应平衡常数K=________。
(2)已知25℃,NH3·H2O的Kb=1.8×105,H2SO3的Ka1=1.3×102,Ka2=6.2×108。若氨水的浓度为2.0 mol·L1,溶液中的c(OH)=_______mol·L1,0.1 mol·L1的(NH4)2SO3溶液显______(填“酸性”、“碱性”或“中性”)。
Ⅱ. 某学生用0.200mol/L的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
①用蒸馏水洗涤碱式滴定管,并注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线稍下,并记下读数
④量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数
请回答:
(1)以上步骤有错误的是______ (填编号)。
(2)用标准NaOH溶液滴定时,应将标准NaOH溶液注入______ 中(从图中选填“甲”或“乙”)。

(3)下列操作会引起实验结果偏大的是:______![]() 填编号
填编号![]() 。
。
A. 在锥形瓶装液前,留有少量蒸馏水
B. 滴定前,滴定管尖嘴有气泡,滴定后无气泡
C. 滴定终点俯视读数
【答案】2.5 2.85×10-3 6.0×10-3 碱性 ① 乙 B
【解析】
Ⅰ.(1)利用“三段式”计算平衡常数和H2S的平衡转化率;(2)根据Kb=![]() 计算c(OH);根据NH3·H2O的电离平衡常数与H2SO3的Ka2大小分析(NH4)2SO3溶液的酸碱性;Ⅱ.(1)碱式滴定管在装液前应用待装液进行润洗;(2)应将标准NaOH溶液注入碱式滴定管;(3)根据c(待测)=
计算c(OH);根据NH3·H2O的电离平衡常数与H2SO3的Ka2大小分析(NH4)2SO3溶液的酸碱性;Ⅱ.(1)碱式滴定管在装液前应用待装液进行润洗;(2)应将标准NaOH溶液注入碱式滴定管;(3)根据c(待测)=![]() 分析不当操作对V(标准)的影响;
分析不当操作对V(标准)的影响;
Ⅰ.(1)
H2S(g)+CO2(g)![]() COS(g) +H2O(g)
COS(g) +H2O(g)
开始 0.16 0.04 0 0
转化 x x x x
平衡 0.16-x 0.04-x x x
![]() ,解得x=0.004,H2S的平衡转化率为
,解得x=0.004,H2S的平衡转化率为![]() ,反应平衡常数K=
,反应平衡常数K=![]() 2.85×10-3 ;
2.85×10-3 ;
(2)Kb=![]() ,所以浓度为2.0 mol·L1溶液中的c(OH)=
,所以浓度为2.0 mol·L1溶液中的c(OH)=![]() =6.0×10-3mol/L; NH3·H2O的电离平衡常数大于H2SO3的Ka2,所以 (NH4)2SO3溶液呈碱性;
=6.0×10-3mol/L; NH3·H2O的电离平衡常数大于H2SO3的Ka2,所以 (NH4)2SO3溶液呈碱性;
Ⅱ.(1)碱式滴定管在装液前应用待装液进行润洗,所以步骤①有错误;
(2)应将标准NaOH溶液注入碱式滴定管,所以选乙;
(3)A. 在锥形瓶装液前,留有少量蒸馏水,对待测液的物质的量无影响,所以对V(标准)无影响,所测浓度无影响,故不选A; B. 滴定前,滴定管尖嘴有气泡,滴定后无气泡,V(标准)偏大,所测浓度偏大,故选B; C. 滴定终点俯视读数,V(标准)偏小,所测浓度偏小,故不选C,答案选B。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究物质结构与性质之间的关系和元素性质的递变规律,设计了如下系列实验。回答下列问题:
I.NaNH2熔点(210℃)比NaOH 熔点(318.4℃)低, 解释原因正确的是 (__________)
A.是因为NaNH2比NaOH 的相对分子质量小,前者分子间作用力小。
B.NaOH存在分子间氢键
C.NaNH2、NaOH均是离子化合物,其熔沸点高低与离子键的强弱有关,阴、阳离子电荷数越高,离子半径越小,离子键强度越大(或离子晶体的晶格能越大),则熔点越高。由于原子半径N>O,且NH2- 比OH- 原子个数多,则NH2- 比OH- 离子半径大,所以NaNH2比NaOH离子晶体的晶格能小,其熔点低。
D.N和O均处于第二周期,N在左方,同周期元素从左到右,元素的非金属性增强,其氢化物水溶液的酸性H2O>NH3,则碱性NaNH2>NaOH
II.根据下图所示装置回答以下问题。
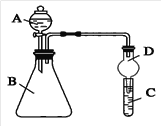
(1)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证Cl的非金属性大于S:锥形瓶中发生反应的离子方程式为_________________________。试管中的实验现象为___________________________。
(2)若要用此装置证明非金属性: N>C>Si,从以下所给物质中选出实验所要用到物质:
①稀HNO3溶液 ②稀硫酸溶液 ③碳酸钙 ④Na2SiO3溶液 ⑤SiO2
试剂A与C分别对应为_________________(填数字序号)。
有同学认为此实验不能说明N、C、Si的非金属性强弱,你认为发生干扰的化学方程式为:_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填写下列空白:
(1)写出表示含有8个质子、10个中子的原子的化学符号:__________。
(2)周期表中最活泼的非金属元素位于第__________纵行。
(3)周期表中位于第4周期、ⅡA族的元素符号是:___________ 。
(4)所含元素为18种的周期是第_________周期、第________周期。
(5)写出第2周期、ⅤA族元素单质的电子式:______________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向一定体积的0.1mol·L-1的Na2CO3溶液中逐滴加入0.1mol·L-1盐酸至过量,溶液中含碳元素的各微粒的物质的量浓度的百分含量随溶液pH的变化如图所示(CO2因逸出未画出,滴加盐酸的过程中温度的变化忽略不计)。下列说法正确的是
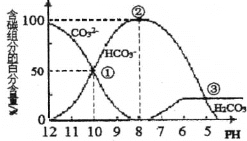
A. 由图可知,碳酸的-lgKa2=10
B. 点②所示溶液中:c(HCO3-)=0.1mol·L-1
C. 当滴加盐酸到点③时,才开始放出CO2气体
D. Na2CO3第一步水解反应的平衡常数:①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示A处通入潮湿的Cl2,关闭活塞B时D中干燥的红色布条颜色无变化;打开活塞B时D处干燥的红色布条褪色,则C中的试剂(足量)不可能是
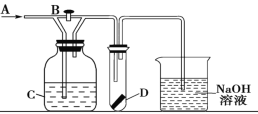
A.饱和氯化钠溶液B.氢氧化钙悬浊液C.饱和碳酸钠溶液D.浓硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp(Ag2CrO4)=9.0×10-12,下列说法正确的是( )
A. 向含有浓度均为0.010 mol·L-1的Cl-和Br-溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,先产生沉淀的离子为Cl-
B. 向饱和AgCl水溶液中加入浓盐酸,Ksp值变大
C. 向AgCl悬浊液中加入足量KBr溶液,沉淀将由白色转化为淡黄色
D. 由方程式:Ag2CrO4(s)![]() 2Ag+(aq)+CrO42-(aq),可推知Ag2CrO4的饱和溶液一定有2c(Ag+)=c(CrO42-)
2Ag+(aq)+CrO42-(aq),可推知Ag2CrO4的饱和溶液一定有2c(Ag+)=c(CrO42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在硫酸铜晶体结晶水含量测定的实验中,会造成实验结果偏低的是( )
A. 加热时间过长,固体部分变黑B. 坩埚内附有不挥发杂质
C. 晶体不纯,含有不挥发杂质D. 加热过程中有少量晶体溅出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组为探究SO2和Fe(NO3)3溶液的反应的实质。设计了如下图所示装置进行实验.
已知:1.0 mol/L的Fe(NO3)3溶液的pH=1。

请回答:
(1)装置A中用于添加浓硫酸的仪器名称为__________________。
(2)实验前鼓入N2的目的是________________________________。
(3)装置B中产生了白色沉淀,其成分是________,说明SO2具有________性。
(4)分析B中产生白色沉淀的原因。
观点1:SO2与Fe3+反应;
观点2:在酸性条件下SO2与NO3-反应;
①若观点1正确,除产生沉淀外,还应观察到的现象是_________________。
②按观点2,装置B中反应的离子方程式是______________________________,
③有人认为,如将装置B中的Fe(NO3)3溶液替换为等体积的下列溶液,在相同条件下进行实验,也可验证观点2是否正确。此时应选择的最佳试剂是(填序号)_____。
A.1 mol/L稀硝酸 |
B.1.5 mol/L Fe(NO3)2溶液 |
C.6.0 mol/L NaNO3溶液和0.2 mol/L盐酸等体积混合的溶液 |
D.3.0 mol/L NaNO3溶液和0.1mol/L硫酸等体积混合的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实,不能用勒夏特列原理解释的是( )
A. 反应CO(g)+NO2(g)![]() CO2(g)+NO(g) ΔH<0,升高温度可使平衡向逆反应方向移动
CO2(g)+NO(g) ΔH<0,升高温度可使平衡向逆反应方向移动
B. 合成NH3的反应,为提高NH3的产率,理论上应采取相对较低的温度
C. 溴水中存在平衡:Br2+H2O![]() HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
D. 对2HI(g)![]() H2(g)+I2(g),增大平衡体系的压强(压缩体积)可使体系颜色变深
H2(g)+I2(g),增大平衡体系的压强(压缩体积)可使体系颜色变深
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com