
����Ŀ����NA��������٤��������ֵ������������ȷ����
A. ��Ǧ���ص���Ȼ�����Һ�õ���״����22.4L����ʱ������Ǧ������������������ĿΪ4NA
B. 1L0.1mol��L��1NH4Cl��Һ�к��еĵ�ԭ����С��0.1NA
C. 3.0g�������Ǻͱ�������ɵĻ�����к��е�ԭ������Ϊ0.3NA
D. ������������Ӧ���ɱ�״����22.4L�Ȼ��⣬���ѻ�ѧ��������Ϊ2NA
���𰸡�A
��������
A����Ǧ���ص���Ȼ�����Һ�õ�22.4L H2���������ת�Ƶ��ӵ����ʵ���Ϊ2mol��Ǧ���ص������缫��ӦʽΪPbO2+2e-+4H+=Pb2++2H2O����֪����4mol�������ӣ�����������Ǧ�����к������Ӹ���Ϊ4NA����A��ȷ��
B. 1L0.1mol��L��1NH4Cl��Һ�к��еĵ�ԭ�ӵ����ʵ���Ϊ1L��0.1molL-1=0.1mol�����Ե�ԭ��������0.1NA����B����
C�������Ǻͱ��������ʽ��ΪCH2O����3.0gCH2O��ԭ����=![]() ��4��NA=0.4NA����C����
��4��NA=0.4NA����C����
D������Ӧ����2molHClʱ������2mol��ѧ�����ʵ����ɱ����22.4LHCl����1molHClʱ������1mol��ѧ������NA������D����
��ѡA��


 �����������Ů��ͯ������ϵ�д�
�����������Ů��ͯ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��������̼����ϡ����������ɵ�ԭ���װ�ã�c��dΪ�����缫�������йص��ж���ȷ����

A.��ع����Ĺ����У�c�缫�ϲ�������
B.��ع���ʱ����Һ��H+��Fe2+��d�ƶ�
C.dΪ����������������Ӧ
D.��ع����Ĺ����У���Һ��SO![]() Ũ�ȷ��������仯
Ũ�ȷ��������仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪Ksp(AgCl)��1.56��10��10��Ksp(AgBr)��7.7��10��13��Ksp(Ag2CrO4)��9.0��10��12������˵����ȷ����(����)
A. ����Ũ�Ⱦ�Ϊ0.010 mol��L��1��Cl����Br����Һ����μ���0.010 mol��L��1��AgNO3��Һʱ���Ȳ�������������ΪCl��
B. ��AgClˮ��Һ�м���Ũ���ᣬKspֵ���
C. ��AgCl����Һ�м�������KBr��Һ���������ɰ�ɫת��Ϊ����ɫ
D. �ɷ���ʽ��Ag2CrO4(s)![]() 2Ag��(aq)��CrO42-(aq)������֪Ag2CrO4�ı�����Һһ����2c(Ag��)��c(CrO42-)
2Ag��(aq)��CrO42-(aq)������֪Ag2CrO4�ı�����Һһ����2c(Ag��)��c(CrO42-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ϊ��ѧ��ѧ�г��������ʣ���Cu�� ��FeCl3��Һ�� ��CuCl2��Һ����CO2����H2SO4���ƾ�����CaCO3����FeSO4����Ba(OH)2��
�����Ҫ��ش������й����⣺
��1���������������ڵ���ʵ���________�����ڷǵ���ʵ���__________��������ţ�
��2�����ڢۢ������Ƴ�Ũ�Ⱦ�Ϊ1molL��1�Ļ����Һ100mL������һ���������ۣ���ַ�Ӧ����������ʣ�࣬����ͭ���ɣ���Ӧ�����Һ��һ�����е���������______��������Ӧ�����ӷ���ʽΪ_____________________________________________________��
��3���������Һ�������ӵ��Լ���________________��֤������ڵ�������____________��
��4�����ˮ����εμ�1 mol��L��1 FeCl3��Һ����Һ������ĺ��ɫ���÷�ɢϵ������ֱ���ķ�Χ��________ nm��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о�С��Ϊ̽��SO2��Fe(NO3)3��Һ�ķ�Ӧ��ʵ�ʡ����������ͼ��ʾװ�ý���ʵ��.
��֪��1.0 mol/L��Fe(NO3)3��Һ��pH��1��

��ش�
��1��װ��A����������Ũ�������������Ϊ__________________��
��2��ʵ��ǰ����N2��Ŀ����________________________________��
��3��װ��B�в����˰�ɫ��������ɷ���________��˵��SO2����________�ԡ�
��4������B�в�����ɫ������ԭ��
�۵�1��SO2��Fe3����Ӧ��
�۵�2��������������SO2��NO3-��Ӧ��
�����۵�1��ȷ�������������⣬��Ӧ�۲쵽��������_________________��
�ڰ��۵�2��װ��B�з�Ӧ�����ӷ���ʽ��______________________________��
��������Ϊ���罫װ��B�е�Fe(NO3)3��Һ�滻Ϊ�������������Һ������ͬ�����½���ʵ�飬Ҳ����֤�۵�2�Ƿ���ȷ����ʱӦѡ�������Լ���(�����)_____��
A��1 mol/Lϡ���� |
B��1.5 mol/L Fe(NO3)2��Һ |
C��6.0 mol/L NaNO3��Һ��0.2 mol/L����������ϵ���Һ |
D��3.0 mol/L NaNO3��Һ��0.1mol/L����������ϵ���Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ���ס�������װ�õ��ձ��зֱ�ʢ��������CuCl2��Һ��
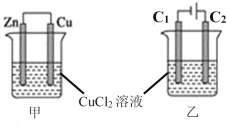
(1)��װ���У�Zn�缫����______��Ӧ������������������ԭ��������Һ��Cl-��_____��������Zn������Cu�����ƶ���Zn�缫��ӦʽΪ_______������Ӧ��������0.1mol���ӷ���ת�ƣ���Cu����������__________��
(2)��װ���У�ʯī�缫C1��_______����������______��C2���缫��ӦʽΪ_______������Ӧ��������������12.8g��Cu�������������������ڱ�״���µ����Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����100mL K2CO3��KAlO2�Ļ����Һ����μ���1mol��L-1�����ᣬ�����Һ�е�CO32-��HCO3-��AlO2-��Al3+���ӵ����ʵ��������������Һ������仯��ϵ����ͼ��ʾ������˵����ȷ����

A. a����Һ�У�c(HCO3-)+c(H2CO3)+c(H+)=c(OH-)
B. b��������Һ��������Ũ�ȴ�С˳��Ϊ��c(Cl-)>c(HCO3-)>c(CO32-)>c(OH-)
C. c����Һ�У�c(Cl-)+c(HCO3-)+c(H2CO3)+c(CO32-)=1.5 mol��L-1
D. d��e�Ĺ�����ˮ�ĵ���̶���С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��Ӧ���ʺ���������������������ء�
��1��ijͬѧΪ��̽��п�����ᷴӦ�����е����ʱ仯���� 400mL ϡ�����м���������п�ۣ����������ˮ�������ռ���Ӧ�ų���������ʵ���¼���£��ۼ�ֵ����
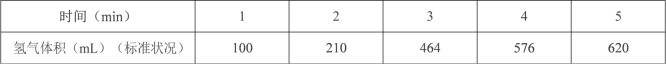
����һʱ��η�Ӧ�������_______min������0��1������1��2������2��3������3��4������4��5������ ԭ����________��
���� 3��4 ����ʱ����������Ũ�ȱ仯����ʾ�ĸ÷�Ӧ����________����Һ������䣩��
��2����ͬѧ����ϡ������п��ȡ������ʵ���У����ּ�����������ͭ��Һ�ɼӿ��������������ʡ���� ���������⣺
������ͭ��Һ���Լӿ������������ʵ�ԭ����_______��
��ʵ���������� Na2SO4��MgSO4��Ag2SO4��K2SO4 �� 4 ����Һ������ʵ���� CuSO4 ��Һ���������õ���_______��
��Ҫ��������ʵ��������������ʣ��ɲ�ȡ�ĺ�����ʩ��_______��_______�������֣���
��3�� ij�¶����� 4 L �ܱ������У�X��Y��Z ������̬���ʵ����ʵ�����ʱ��仯������ͼ��
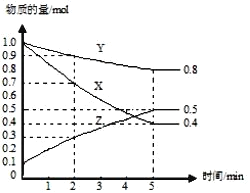
�ٸ÷�Ӧ�Ļ�ѧ����ʽ��_______��
�ڸ÷�Ӧ�ﵽƽ��״̬�ı�־��_______������ĸ��
A��Y ����������ڻ�������б��ֲ��� B��X��Y �ķ�Ӧ���ʱ�Ϊ 3��1
C������������ѹǿ���ֲ��� D����������������������ֲ���E������ 1 mol Y ��ͬʱ���� 2 mol Z
��2 min �� Y ��ת����Ϊ_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��N2O5��һ�������������������ʺ��Ʊ��������ǵĹ�ע��
��1��һ���¶��£���2L�����ܱյ������г���2.0molN2O5������Ӧ��2N2O5��g��![]() 4NO2��g��+O2��g���������ֲ�ͬ�������½���ʵ�飬N2O5��Ũ����ʱ��ı仯��ͼ��ʾ��
4NO2��g��+O2��g���������ֲ�ͬ�������½���ʵ�飬N2O5��Ũ����ʱ��ı仯��ͼ��ʾ��

����֪��2N2O5��g��===2N2O4��g��+O2��g�� ��H1=-4.4kJ/mol
2NO2��g��===N2O4��g�� ��H2=-55.3 kJ/mol
��Ӧ2N2O5��g��===4NO2��g��+O2��g���ġ�H=________��
�����в���˵���÷�Ӧ�Ѵ�ƽ��״̬����___������ţ���
A��v����N2O5��=2v����O2��
B����������ܶȲ���
C�������ƽ��Ħ������
D��NO2�������������
�۸÷�Ӧ�Է����е�������____������¡����¡�����ʵ����У�a��v����O2��____���<����>����b��v����O2����
��ʵ���ӷ�Ӧ��ʼ��ƽ��ʱ��v��O2��=____mol/��L��min����
����ʽ������÷�Ӧ��800��ʱ��ƽ�ⳣ��K=_______��
��2��1840��Devil�ø��������ͨ�����������������Ӧ�õ�N2O5���÷�Ӧ������������һ�����壬�÷�Ӧ�Ļ�ѧ����ʽΪ_______��
��3��N2O5Ҳ�ɲ��á���ⷨ���Ʊ���װ����ͼ��ʾ��

��N2O5�ڵ��ص�____������������������������ɣ���缫��ӦʽΪ_____��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com