
����Ŀ������Ϊ��ѧ��ѧ�г��������ʣ���Cu�� ��FeCl3��Һ�� ��CuCl2��Һ����CO2����H2SO4���ƾ�����CaCO3����FeSO4����Ba(OH)2��
�����Ҫ��ش������й����⣺
��1���������������ڵ���ʵ���________�����ڷǵ���ʵ���__________��������ţ�
��2�����ڢۢ������Ƴ�Ũ�Ⱦ�Ϊ1molL��1�Ļ����Һ100mL������һ���������ۣ���ַ�Ӧ����������ʣ�࣬����ͭ���ɣ���Ӧ�����Һ��һ�����е���������______��������Ӧ�����ӷ���ʽΪ_____________________________________________________��
��3���������Һ�������ӵ��Լ���________________��֤������ڵ�������____________��
��4�����ˮ����εμ�1 mol��L��1 FeCl3��Һ����Һ������ĺ��ɫ���÷�ɢϵ������ֱ���ķ�Χ��________ nm��
���𰸡��ݢߢ�� �ܢ� Fe2+����дH+Ҳ�ɣ� 2Fe3++Fe��3Fe2+ Fe+ Cu2+�� Fe2++ Cu KSCN��Һ ��Һ��� 1~100nm
��������
��ˮ��Һ�������״̬���ܹ�����Ļ������������ʣ��ᡢ��ζ��ǵ���ʣ���ˮ��Һ�������״̬�¶����ܵ���Ļ�����зǵ���ʡ��ݴ˷�����
(1)��ˮ��Һ�������״̬���ܹ�����Ļ������������ʣ��ᡢ��ζ��ǵ���ʣ���ˮ��Һ�������״̬�¶����ܵ���Ļ�����зǵ���ʡ���C u�ǵ��ʣ����ʼȲ��ǵ����Ҳ���Ƿǵ�������ں͢۶�����Һ����Һ�ǻ��������Ȳ��ǵ����Ҳ���Ƿǵ��������CO2��ˮ��Һ�����ܵ��磬����������Ӳ���CO2�������������ʵ����H2CO3��Һ���磬��ʵ��Һ̬��CO2�����磬����CO2�Ƿǵ��������H2SO4���ᣬ���ڵ�������ƾ���ˮ��Һ��ʹ�Һ̬ʱ�������磬���Ծƾ����ڷǵ��������CaCO3���Σ����ڵ��������FeSO4���Σ����ڵ��������Ba(OH)2�Ǽ���ڵ�������𰸣����ڵ���ʵ��Ǣݢߢ�ᣬ���ڷǵ�����Ǣܢޣ�
(2)������֪�����Ƶ���Һ�к�Fe3+��Fe2+��Cu2+�������ӣ�����������ǿ����Fe3+>Cu2+>Fe2+����֪�������۷�����Ӧ���Ⱥ�˳���ǣ�2Fe3++Fe=3Fe2+��Cu2++Fe=Cu+Fe2+�����Է�Ӧ����Һ��һ�����е���������Fe2+��
(3)Fe3+��SCN-��Ӧ���ɿ�����ˮ�ĺ�ɫ����Fe(SCN)3��Fe3++3SCN-=Fe(SCN)3�������������������Fe3+�Ĵ��ڣ�������ѡ�Լ���KSCN��Һ��֤��Fe3+���ڵ���������Һ��졣
(4)���ˮ����εμ�1 mol��L��1 FeCl3��Һ����Һ������ĺ��ɫ������ӦΪFe3++3H2O![]() Fe(OH)3(����)+3H+�����ĺ��ɫҺ�����Fe(OH)3���壬���������ֱ���ķ�Χ��1nm~100nm��
Fe(OH)3(����)+3H+�����ĺ��ɫҺ�����Fe(OH)3���壬���������ֱ���ķ�Χ��1nm~100nm��


 ��ǰ����ϵ�д�
��ǰ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���۲�����װ�ã��ش��������⣺

(1)��װ����ͨ���Ҵ��ĵ缫��ӦʽΪ_______________________________________��
(2)����ͼװ�õ��200 mL 1 mol/L CuSO4��Һһ��ʱ�䣬���׳�������112 mL O2������£�����ʱ��װ������Һ��pHΪ______�����Ե��ǰ������仯������Ҫ������Һ��ȫ�ָ������ǰ��Ũ�Ⱥ�pH����Ҫ�����������______�������ʵ���Ϊ________��
(3)��װ�����ܷ�Ӧ�����ӷ���ʽΪ___________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��B��C��Dԭ���������ε����Ķ���������Ԫ�أ����³�ѹ��AB2��һ�ֺ���ɫ���壬B��Cͬ���壬��
(1)CԪ�������ڱ��е�λ��____________��
(2)����DԪ�صļ����ӽṹʾ��ͼ_______________________��
(3)��CB2��D2�������1��1��Ϻ�ͨ��Ʒ����Һ�У�Ʒ����Һ����ɫ������һ����ѧ����ʽ�����ͣ�_________________________________��
(4)AB2��ˮ��Ӧ�Ļ�ѧ����ʽΪ___________����һ���¶Ⱥ�ѹǿ�£���һ���ݻ�Ϊ15mL���Թܳ���AB2������һ��ʢˮ��ˮ���У����Թ�Һ��������һ���߶Ȳ��ٱ仯ʱ����ͬ��������ͨ��O2����Ҫʹ�Թ�Һ���Ա�����ԭ�߶ȣ���Ӧͨ���O2Ϊ___________mL��
(5)�ס��ҡ�����Ϊ��AԪ�صĻ������Ϊ���ʣ��ס��ҡ���������������������ת����ϵ(��Ӧ���������ֲ�������ȥ)
![]()
������Ϊһ�ֳ����ķǽ������ʣ���Ϊ�⻯���Ϊ�������һ���ҷ��������еĵ�����Ŀ___________��
������Ϊһ�ֳ����Ľ������ʣ������¶��ڼ�Ũ��Һ���ܷ�Ӧ���ܿ�ֹͣ������Ļ�ѧʽ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NA���������ӵ�������ֵ������˵����ȷ����
A. ���³�ѹ�£�124 g P4������P��P����ĿΪ4NA
B. 100 mL 1mol��L1FeCl3��Һ������Fe3+����ĿΪ0.1NA
C. ��״���£�11.2 L�������ϩ������к���ԭ����ĿΪ2NA
D. �ܱ������У�2 mol SO2��1 mol O2����Ӧ���������Ϊ2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ԭ����ǻ�ѧ��Դ�ij��Ρ�������ͼ��ʾԭ��ص�˵����ȷ����
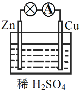
��1����ͼ���Ӻ�װ�ú���������__���Zn����Cu������ͭ�缫����������_____��
��2����Ӧԭ��ص��ܷ�Ӧ����ʽΪ____��
��3�����л�ѧ��Ӧ��ͨ��ԭ���װ�ã���ʵ�ֻ�ѧ��ֱ��ת��Ϊ���ܵ���__������ţ�
��2NaOH+H2SO4=Na2SO4+2H2O
��Cu+2Fe3+=Cu2++2Fe2+
��C2H5OH+3O2![]() 2CO2+3H2O
2CO2+3H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йػ�ѧ��Ӧ���ʵ�˵���У���ȷ���ǣ� ��
A. ��ӦC(s)+H2O(g)![]() CO(g)+H2(g)������̼�������ɼӿ췴Ӧ����
CO(g)+H2(g)������̼�������ɼӿ췴Ӧ����
B. ����Ƭ��ϡ���ᷴӦ��H2������98%��Ũ����ɼӿ�����H2������
C. ��пƬ��ϡ���ᷴӦ������������NaCl��Һ����Ӧ���ʲ���
D. ��Ӧ2SO2(s)+O2(g)![]() 2SO3(g)���ܱ������н��У�ѹ�������������Ӧ��������
2SO3(g)���ܱ������н��У�ѹ�������������Ӧ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��������٤��������ֵ������������ȷ����
A. ��Ǧ���ص���Ȼ�����Һ�õ���״����22.4L����ʱ������Ǧ������������������ĿΪ4NA
B. 1L0.1mol��L��1NH4Cl��Һ�к��еĵ�ԭ����С��0.1NA
C. 3.0g�������Ǻͱ�������ɵĻ�����к��е�ԭ������Ϊ0.3NA
D. ������������Ӧ���ɱ�״����22.4L�Ȼ��⣬���ѻ�ѧ��������Ϊ2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о������仯����Ի�����������Ҫ���塣
��1����֪��N2(g)+O2(g)=2NO(g); ��H=+180 kJ��mol��1
4NH3(g)+5O2(g) =4NO(g)+6H2O(g); ��H= ��908 kJ��mol��1
��д��������һ����������������������Ȼ�ѧ����ʽ��___________��
��2����ҵ�ϳɰ���ԭ��Ϊ��N2(g)+3H2(g)![]() 2NH3(g) ��H=��92.4 kJ��mol��1����ͼ�ױ�ʾ��һ��������ܱ������з�ӦʱN2�����ʵ���Ũ����ʱ��ı仯��ͼ�ұ�ʾ�������������������£��ı���ʼͶ����H2��N2�����ʵ���֮�ȣ���Ϊk���Ը�ƽ���Ӱ�졣
2NH3(g) ��H=��92.4 kJ��mol��1����ͼ�ױ�ʾ��һ��������ܱ������з�ӦʱN2�����ʵ���Ũ����ʱ��ı仯��ͼ�ұ�ʾ�������������������£��ı���ʼͶ����H2��N2�����ʵ���֮�ȣ���Ϊk���Ը�ƽ���Ӱ�졣

����֪ͼ����0��t1 min�ڣ�v(H2)=0.03 mol��L-1��min-1����t1=________ min������t2 min����ı�һ����Ӧ�����������ı������������____________________________����һ�ּ��ɣ���
��ͼ���У�b��ʱk=_________��
����֪ij�¶��¸÷�Ӧ��ƽ�ⳣ��K=10���ڸ��¶�����������ͬʱ��������Ũ�ȵĻ�����壺c(H2)=0.1 mol/L��c(N2)=0.5 mol/L��c(NH3)=0.1 mol/L������ƽ�⽨��������NH3��Ũ�ȱ仯������__________������������������С�������㶨����������
��3���������ֳ��£�N2H4����ɫҺ�壩Ϊ��Ԫ�����ˮ�еĵ��뷽ʽ�백���ƣ���һ��Ӧ�ù㷺�Ļ���ԭ�ϣ����������ȼ�ϡ�����֪��N2H4+H+![]() N2H5+��
N2H5+��
��N2H5+�ĵ���ʽΪ_______�������������γɵ���ʽ�εĻ�ѧʽΪ________��
��������һ�ֳ��õĻ�ԭ������װ������AgCl���Թ��м���������Һ���۲쵽������___________________________________________________________��
��4������(CO(NH2)2)��Ŀǰʹ�����ϴ��һ�ֻ�ѧ���ʣ���ҵ��������ͼ��ʾװ��(����������Ϊ���Ե缫)������صļ�����Һ��ȡ������
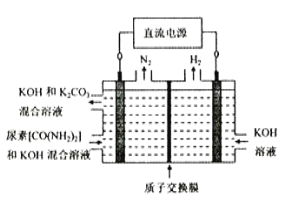
�ٸ�װ�����������ܵ缫��ӦʽΪ_____________________________________________��
�����������ռ�������22.4L(��״��)�������ĵ�����Ϊ____________g(����������ܽ�)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ȤС��̽��SO2���廹ԭFe3��������ʹ�õ�ҩƷ��װ����ͼ��ʾ������˵������������(����)
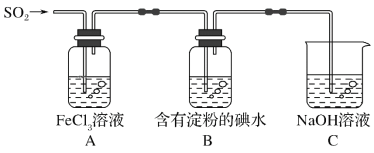
A.�ܱ���I���Ļ�ԭ������SO2��������B����ɫ��Һ��ɫ
B.װ��C������������SO2β������ֹ��Ⱦ����
C.Ϊ����֤A�з�����������ԭ��Ӧ��������ϡ�����ữ��BaCl2��Һ��������ɫ����
D.Ϊ����֤A�з�����������ԭ��Ӧ������KMnO4��Һ���Ϻ�ɫ��ȥ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com