
【题目】观察下列装置,回答下列问题:

(1)甲装置中通入乙醇的电极反应式为_______________________________________;
(2)用上图装置电解200 mL 1 mol/L CuSO4溶液一段时间,当甲池消耗了112 mL O2(标况下),此时乙装置中溶液的pH为______(忽略电解前后体积变化)。若要将该溶液完全恢复到电解前的浓度和pH,需要补充的物质是______,其物质的量为________。
(3)丙装置中总反应的离子方程式为___________________。
【答案】C2H5OH-12e-+16OH- =2CO32-+11H2O 1 CuO 0.01mol Mg2++2Cl-+2H2O ![]() Mg(OH)2↓+H2↑+Cl2↑
Mg(OH)2↓+H2↑+Cl2↑
【解析】
(1)通入燃料乙醇的电极为负极,通入氧气的电极为正极;负极发生氧化反应,电极反应式要结合溶液的酸碱性书写;
(2)与正极连接的电极为阳极,阳极发生氧化反应;与电源负极连接的电极为阴极,阴极发生还原反应;整个闭合回路中电子转移数目相等,两个电极从溶液中析出的物质反应得到的物质就是使溶液复原需要加入的物质;根据电子转移数目计算反应后溶液中产生的n(H+),结合c=![]() 、pH=-lgc(H+)计算溶液的pH;
、pH=-lgc(H+)计算溶液的pH;
(3)先判断溶液中阴、阳离子的放电顺序,书写出两个电极的电极反应,结合同一闭合回路中电子转移数目相等,将两个电极反应式进行叠加,就得到电解的总反应方程式,书写时要结合物质的溶解性及电解质的强弱,确定物质实际存在方式。
(1)根据装置图可知甲装置为原电池,乙、丙装置为电解池。其中甲装置中通入乙醇的电极为负极,乙醇失去电子,发生氧化反应,由于为碱性环境,所以乙醇被氧化产生的CO2与碱反应变为CO32-,电极反应式为C2H5OH-12e-+16OH- =2CO32-+11H2O;通入O2的电极为正极,正极上发生还原反应,电极反应式为O2+4e-+2H2O=4OH-;
(2)n(O2)=0.112L÷22.4L/mol=0.005mol,n(e-)=4n(O2)=4×0.005mol=0.02mol,电解方程式:2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4,根据方程式可知,每转移4mol电子,产生4molH+,则转移电子0.02mol,产生氢离子的物质的量为0.02mol,c(H+)=0.02mol÷0.2L=0.1mol/L,所以溶液的pH=1;通过电解方程式可知:两个电极一个出Cu,一个出O2,二者反应产生的物质CuO就是使溶液复原需加入的物质,n(CuO)=2n(O2)=2×0.005mol=0.01mol;
2Cu+O2↑+2H2SO4,根据方程式可知,每转移4mol电子,产生4molH+,则转移电子0.02mol,产生氢离子的物质的量为0.02mol,c(H+)=0.02mol÷0.2L=0.1mol/L,所以溶液的pH=1;通过电解方程式可知:两个电极一个出Cu,一个出O2,二者反应产生的物质CuO就是使溶液复原需加入的物质,n(CuO)=2n(O2)=2×0.005mol=0.01mol;
(3)在丙装置中用惰性电极电解MgCl2溶液,阳离子放电顺序:H+>Mg2+,所以阴极上H+放电,发生反应:2H++2e-=H2↑,阴离子放电顺序:Cl->OH-,在阳极上发生反应:2Cl- -2e-=Cl2↑,溶液中的Mg2+与阴极上产生的OH-结合形成Mg(OH)2沉淀,由于在整个闭合回路中电子转移数目相等,所以总反应的离子方程式为Mg2++2Cl-+2H2O ![]() Mg(OH)2↓+H2↑+Cl2↑。
Mg(OH)2↓+H2↑+Cl2↑。


科目:高中化学 来源: 题型:
【题目】如下图,在盛有稀硫酸的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,下列关于该装置的说法正确的是

A.外电路电流方向为:X—外电路—Y
B.若两极分别为铁棒和碳棒,则X为碳棒,Y为铁棒
C.X极上发生的是还原反应,Y极上发生的是氧化反应
D.若两极都是金属,则它们的活动性顺序为X>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源与材料、信息一起被称为现代社会发展的三大支柱。面对能源枯竭的危机,提高能源利用率和开辟新能源是解决这一问题的两个主要方向。
(1)化学反应速率和限度与生产、生活密切相关,这是化学学科关注的方面之一。某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水法收集反应放出的氢气,实验记录如下(累计值):
时间/min | 1 | 2 | 3 | 4 | 5 |
氢气体积/mL(标况) | 100 | 240 | 464 | 576 | 620 |
①哪一段时间内反应速率最大:__________min(填“0~1”“1~2”“2~3”“3~4”或“4~5”)。
②另一学生为控制反应速率防止反应过快难以测量氢气体积。他事先在盐酸中加入等体积的下列溶液以减慢反应速率但不影响生成氢气的量。你认为可行的是____________(填字母序号)。
A.KCl溶液 B.浓盐酸 C.蒸馏水 D.CuSO4溶液
(2)如图为原电池装置示意图:

①将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,作负极的分别是_______(填字母)。
A.铝片、铜片 B.铜片、铝片
C.铝片、铝片 D.铜片、铜片
写出插入浓硝酸溶液中形成的原电池的负极反应式:_______________。
②若A为Cu,B为石墨,电解质为FeCl3溶液,工作时的总反应为2FeCl3+Cu=2FeCl2+CuCl2。写出B电极反应式:________;该电池在工作时,A电极的质量将_____(填“增加”“减小”或“不变”)。若该电池反应消耗了0.1mol FeCl3,则转移电子的数目为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】300 mLAl2(SO4)3溶液中,含Al3+1.62 g,在该溶液中加入0.1molL﹣1Ba(OH)2溶液100mL,反应后溶液中SO42-的物质的量浓度约为( )
A. 0.4molL﹣1B. 0.3molL﹣1C. 0.2molL﹣1D. 0.1molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为严厉打击食品生产经营中违法添加非食用物质、滥用食品添加剂,卫生部、农业部等部门联合公布了包含硫酸亚铁在内的22种“易滥用食品添加剂”名单。某同学为探究富含硫酸亚铁且保存时间较长的食品情况,设计了如下实验方案:
![]()
(1)试剂1的主要成分的化学式是________。
(2)加入新制氯水后溶液红色加深的原因是_____________(用离子方程式表示)。
(3)该同学在实验中加入了过量氯水,放置一段时间后,发现深红色褪去,现对褪色原因进行探究。
①提出假设
假设1:溶液中的+3价铁被氧化为更高价态的铁;
假设2:___________。
②设计方案
为了对你所提出的假设2进行验证,请写出一种实验方案:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知N2+3H2![]() 2NH3为放热反应,对该反应的下列说法中正确的是
2NH3为放热反应,对该反应的下列说法中正确的是
A.N2的能量一定高于NH3
B.H2的能量一定高于NH3
C.N2和H2的总能量一定高于NH3的总能量
D.因该反应为放热反应,故不必加热就可发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是铁棒和碳棒在稀硫酸中所组成的原电池装置,c、d为两个电极。下列有关的判断正确的是

A.电池工作的过程中,c电极上产生气泡
B.电池工作时,溶液中H+和Fe2+向d移动
C.d为负极,发生氧化反应
D.电池工作的过程中,溶液中SO![]() 浓度发生显著变化
浓度发生显著变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛的电解冶炼法,如图所示。以含少量CaC12的CaO熔融物作为介质,电解时阴极生成的Ca进一步还原TiO2得到钛。下列说法不正确的是
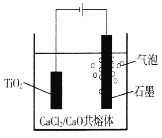
A. Ca还原TiO2的化学方程式为2Ca+TiO2===Ti+2CaO
B. 阳极石墨稳定性强,在实际生产过程中质量几乎不会改变
C. CaC12的作用可能是增强导电性,同时起到助熔剂的作用
D. 已知F=96500C·mol-1,当I=0.5A,通电80分钟,理论上可得Ti的质量为(0.5×80×60×48)/4×96500g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下为中学化学中常见的物质:①Cu; ②FeCl3溶液; ③CuCl2溶液;④CO2;⑤H2SO4;⑥酒精;⑦CaCO3;⑧FeSO4;⑨Ba(OH)2。
请根据要求回答下列有关问题:
(1)以上物质中属于电解质的是________;属于非电解质的是__________。(填序号)
(2)将②③⑧混合配制成浓度均为1molL﹣1的混合溶液100mL,加入一定量的铁粉,充分反应后,若铁粉无剩余,且有铜生成.则反应后的溶液中一定含有的阳离子是______,发生反应的离子方程式为_____________________________________________________。
(3)检验②溶液中阳离子的试剂是________________,证明其存在的现象是____________。
(4)向沸水中逐滴滴加1 mol·L-1 FeCl3溶液,至液体呈透明的红褐色,该分散系中粒子直径的范围是________ nm。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com