
【题目】下列措施对增大反应速率明显有效的是( )
A.Al在氧气中燃烧生成Al2O3 , 将Al粉改为Al片
B.Fe与稀盐酸反应制取H2时,改用氢离子浓度相同的稀硫酸
C.Zn与稀硫酸反应时,适当提高溶液的温度
D.Na与水反应时增大水的用量
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]
罗氟司特是用于治疗慢性阻塞性肺病的新型药物,可通过以下方法合成:
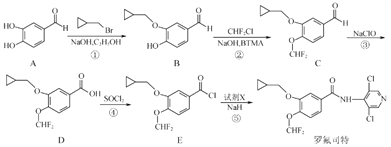
(1)化合物C中的含氧官能团为___________和___________(填名称)。
(2)反应⑤中加入试剂X的分子式为C5H4N2Cl2,则X的结构简式为__________________________。
(3)上述①~④反应中,不属于取代反应的是_______________(填序号)。
(4)写出反应①的化学反应方程式___________________________________。
(5)B的一种同分异构体满足下列条件:
Ⅰ能发生很镜反应,能与FeCl3溶液发生显色反应;
Ⅱ分子中有4种不同化学环境的氢原子。
写出一种该同分异构体的结构简式________________________________。
(6)已知:RBr![]() RNH2根据已有知识并结合相关信息,写出以
RNH2根据已有知识并结合相关信息,写出以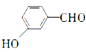 和CH3CH2OH为原料制备
和CH3CH2OH为原料制备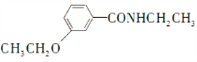 的合成路线流程图(无机试剂任用) ________________________
的合成路线流程图(无机试剂任用) ________________________
合成路线流程图示例如下:
H2C=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH
CH3CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知p(A)=-lgc(A),三种金属硫化物在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
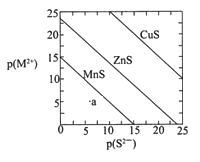
A. a点无MnS沉淀生成
B. CuS和MnS的悬浊液中,c(Cu2+)/c(Mn2+)=10-20
C. 向MnS悬浊液中加入少量CuCl2固体,c(Mn2+) 减小
D. 向含等浓度ZnCl2 和CuCl2的溶液中逐滴加入饱和Na2S溶液,先析出的是ZnS
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】兴趣小组在实验室用制备的氯气与一氧化氮在常温常压下合成亚硝酰氯。
【查阅资料】亚硝酰氯(NOCl,熔点:-64.5℃,沸点:-5.5℃)是一种黄色气体,液体状态呈红褐色,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。对眼睛、皮肤和粘膜有强烈刺激性,具有类似氯气和氮氧化物的毒作用。冰水中加入NaCl可降低温度。
【原料制备】在实验室分别制备原料气NO和Cl2。
(1)用如下装置制备纯净干燥的气体,请补充下表中各仪器中的试剂_______。
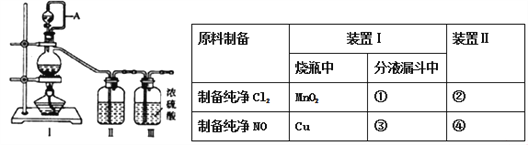
【合成亚硝酰氯】利用制得的NO和Cl2制备NOCl,装置如图所示:
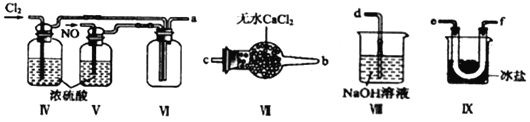
(2)装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,另一个作用是___________________。
(3)装置连顺序为a→_______________(按气流自左向右方向,用小写字母表示)。
(4)装置Ⅶ的作用是___________________________________。
(5)装置Ⅸ在实验时,预期观察到的现象是__________________________________。
(6)装置Ⅷ中吸收尾气时,NOCl发生反应的化学方程式为________________________。
【拓展学习】
(7)查阅资料,得知配制王水(浓硝酸与浓盐酸的混酸)时会生成亚硝酰氯和氯气,该反应的化学方程式为__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是 ( )
A. 在NaClO和NaCl的混合溶液中,Ag+、K+、NO3-、I-可以大量共存
B. Kw/C(H+) =1×10-13mol·L-1的溶液中: NH4+、Ca2+、Cl-、NO3-
C. ![]() 在溶液中能大量共存,通过量
在溶液中能大量共存,通过量![]() 后仍能大量共存
后仍能大量共存
D. 水电离的c(H+)=1×10-13mol·L-1的溶液中:K+、Na+、Al![]() 、C
、C![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 X、Y、Z、W均为短周期元素,他们在元素周期表的位置如下图所示。若Y原子的最外层电子数与电子总数之比为3:4,下列说法正确的是

A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性:Z>W>X
C. 气态氢化物的稳定性:Z>W
D. W的单质能与水反应,生成一种具有漂白性的物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是
A. C3H8中碳原子都采用的是sp3杂化
B. O2、CO2、N2都是非极性分子
C. 酸性:H2CO3<H3PO4<H2SO4<HClO
D. CO的一种等电子体为NO+,它的电子式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某地湖盐中含有Ca2+、Mg2+、Fe3+、SO42-等杂质离子,氨碱厂用该地湖盐制取烧碱。其中制得精制食盐水的过程如下:

(1)过程Ⅰ中将粗盐加水溶解需要适当加热,其目的是____________________________。
(2)过程Ⅱ的目的是除去SO42-,加入的X溶液是________________________。
(3)下表是过程Ⅱ、Ⅲ中生成的部分沉淀及其在20℃时的溶解度[g/(100gH2O):
CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 | Fe(OH)3 |
2.6×10-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 | 4.8×10-9 |
①过程Ⅲ中生成的主要沉淀除CaCO3和Fe(OH)3外还有_______________________。
②过程Ⅳ中调节pH时发生的主要反应的离子方程式为_________________________________。
(4)上述精制食盐水中还含有微量的I-、IO3-、NH4+、Ca2+、Mg2+,除去这些离子及进行电解的流程如下:
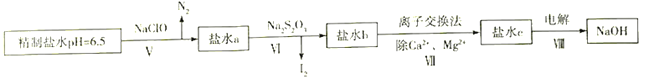
①过程Ⅴ生成N2的离子方程式为__________________________________。
②过程Ⅵ可以通过控制Na2S2O3的量,将IO3-还原为I2,且盐水b中含有SO42-,该过程中发生氧化还原反应,其中氧化剂和还原剂的物质的量之比为________________________________。
③在过程Ⅳ中所用的Na2S2O3俗称海波,是一种重要的化工原料。商品海波主要成分是Na2S2O3·5H2O。为了测定其含Na2S2O3·5H2O的纯度,称取8.00 g样品,配成250 mL溶液,取25.00 mL于锥形瓶中,滴加淀粉溶液作指示剂,再用浓度为0.050 0 mol·L-1的碘水滴定(发生反应2S2O32-+I2==S4O62-+2I-),下表记录滴定结果:
滴定次数 | 滴定前读数(mL) | 滴定后读数(mL) |
第一次 | 0.30 | 29.12 |
第二次 | 0.36 | 30.56 |
第三次 | 1.10 | 29.88 |
计算样品的纯度为________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com