
【题目】某![]() 、
、![]() 的混合溶液中逐滴加入
的混合溶液中逐滴加入![]() 的盐酸,测得溶液中的
的盐酸,测得溶液中的![]() 、
、![]() 、
、![]() 、
、![]() 的物质的量与加入盐酸溶液的体积变化关系如图所示.则下列说法正确的是
的物质的量与加入盐酸溶液的体积变化关系如图所示.则下列说法正确的是![]()
![]() 已知:
已知:![]() 的电离平衡常数
的电离平衡常数![]() ,
,![]() ;
;![]() 的酸式电离平衡常数
的酸式电离平衡常数![]()
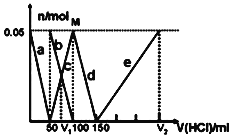
A.a曲线表示的离子方程式为:![]()
B.M点时生成的![]() 为
为![]()
C.原混合溶液中的![]() 与
与![]() 的物质的量之比为1:2
的物质的量之比为1:2
D.![]() :
:![]() :4
:4
【答案】D
【解析】
![]() 、
、![]() 的混合溶液中逐滴加入
的混合溶液中逐滴加入![]() 的盐酸,先发生的反应为:
的盐酸,先发生的反应为:![]() ,则a曲线表示
,则a曲线表示![]() ,由图可知
,由图可知![]() 反应完毕,加入盐酸50mL,根据方程式可知:
反应完毕,加入盐酸50mL,根据方程式可知:![]() ;
;![]() 反应完毕后发生反应:
反应完毕后发生反应:![]() ,b曲线表示
,b曲线表示![]() ,c曲线表示
,c曲线表示![]() ,由图可知
,由图可知![]() 反应完毕,该阶段加入盐酸体积为:
反应完毕,该阶段加入盐酸体积为:![]() ,根据方程式可知:
,根据方程式可知:![]() ;
;![]() 反应完后又发生反应:
反应完后又发生反应:![]() ,d曲线表示
,d曲线表示![]() ,由图可知
,由图可知![]() 反应完毕,该阶段加入盐酸体积为:
反应完毕,该阶段加入盐酸体积为:![]() ,根据方程式可知:
,根据方程式可知:![]() ;最后发生反应为:
;最后发生反应为:![]() ,e曲线表示
,e曲线表示![]() ,根据方程式可知:
,根据方程式可知:![]() ,该阶段加入盐酸体积为:
,该阶段加入盐酸体积为:![]() ;
;
A. a曲线表示的离子方程式为:![]() ,选项A错误;
,选项A错误;
B. M点时生成的![]() 为
为![]() +
+![]() =1mol,选项B错误;
=1mol,选项B错误;
C. 原混合溶液中的![]() 与
与![]() 的物质的量之比为
的物质的量之比为![]() :
:![]() =1:1,选项C错误;
=1:1,选项C错误;
D. ![]() :
:![]() :4,选项D正确。
:4,选项D正确。
答案选D。


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
【题目】已知X(g)+3Y (g)![]() 2W(g) +M (g) △H=-a kJ·mol-1(a>0)。一定温度下,在体积恒定的密闭容器中,加入1 mol X(g) 与2mol Y (g),下列说法正确的是( )
2W(g) +M (g) △H=-a kJ·mol-1(a>0)。一定温度下,在体积恒定的密闭容器中,加入1 mol X(g) 与2mol Y (g),下列说法正确的是( )
A.充分反应后,X的转化率和Y的转化率不相等,前者大于后者
B.当反应达到平衡状态时,W与M的物质的量浓度之比一定为2:1
C.当混合气体的密度不再改变,表明该反应已达平衡
D.若增大Y的浓度,正反应速率增大,逆反应速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO是常见的气体污染物,消除NO废气是环境科学研究的热点课题。
(1)H2还原法
已知:①![]()
②![]()
则H2还原NO的热化学方程式为__________________________________。
(2)活性炭还原法
在容积为1L、温度恒定的密闭容中加入1mol NO和足量的活性炭,发生反应C(s) + 2NO(g) ![]() N2(g) + CO2 (g) H,测得物质浓度变化如图所示。
N2(g) + CO2 (g) H,测得物质浓度变化如图所示。
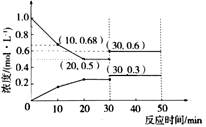
①0-10min内,用活性炭表示的平均反应速率为_________g/min。
②关于该反应的下列叙述正确的是________。
A.压强保持不变说明反应达到平衡
B.混合气体密度保持不变说明反应达到平衡
C.30min时,改变的条件可能是缩小容器体积
D.选择合适的催化剂,能提高NO的平衡转化率
③保持条件不变,若第30min时向容器中加入0.5mol CO2和0.5mol NO,则此时平衡___移动(填“正向”“逆向”或“不”)。判断的依据是_____________________________________。
(3)CO还原法
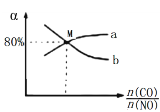
将总物质的量为2mol的CO与NO混合气体充入1L的密闭容器中,发生反应:2NO(g) + 2CO(g) ![]() 2CO2(g) + N2(g),保持温度和压强不变,测得平衡时NO、CO的转化率(α)与CO和NO物质的量比例关系如图。NO的转化率曲线为_____(填“a”或“b”)。M点的起始n(CO)=______mol。该反应的平衡常数K=___________。
2CO2(g) + N2(g),保持温度和压强不变,测得平衡时NO、CO的转化率(α)与CO和NO物质的量比例关系如图。NO的转化率曲线为_____(填“a”或“b”)。M点的起始n(CO)=______mol。该反应的平衡常数K=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业对国民经济和社会发展具有重要的意义,对密闭容器中的反应:N2(g)+3H2(g) ![]() 2NH3(g) △H<0。400℃、30MPa下n(NH3)和n(H2)随时间变化的关系如图,下列叙述错误的是( )
2NH3(g) △H<0。400℃、30MPa下n(NH3)和n(H2)随时间变化的关系如图,下列叙述错误的是( )
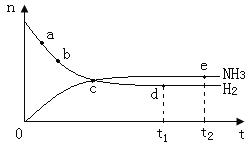
A.点a的正反应速率比b点的大
B.点c处反应还未达到平衡
C.点d(t1时刻)和点e(t2时刻)处n(N2)不一样
D.其他条件不变,500℃下反应至t1时刻,n(H2)比右图中d点的值大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下面的信息,下列叙述正确的是( )
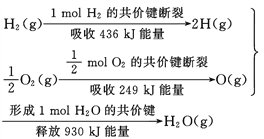
A. 2 mol H2(g)跟 1 mol O2(g)反应生成 2 mol H2O(g)吸收能量为490 kJ
B. 化学反应中能量变化的大小与反应物的质量多少无关
C. 1 mol H2(g) 跟0.5mol O2(g) 反应生成 1 mol H2O(l)释放能量为245 kJ
D. 2molH2O (g)的能量比2 mol H2(g)与1 mol O2(g)的能量之和低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W原子序数依次增大,Y的原子半径是短周期主族元素原子中最大的,X与Z属于同一主族,Z的最外层电子数为最内层电子数的3倍。下列说法正确的是
A.原子半径: r(Y)>r(W)>r(Z)>r(X)
B.由X、Y组成的化合物中均不含共价键
C.W的氧化物对应水化物的酸性比Z的强
D.X的简单气态氢化物的热稳定性比Z的强
查看答案和解析>>
科目:高中化学 来源: 题型:
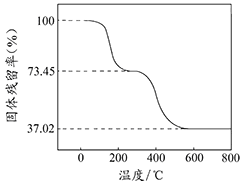
【题目】碱式碳酸铝镁[MgaAlb(OH)c(CO3)d·x H2O]常用作塑料阻燃剂。
(1)碱式碳酸铝镁具有阻燃作用,是由于其受热分解需吸收大量热量和_________。
(2)MgaAlb(OH)c(CO3)d·x H2O中a、b、c、d的代数关系式为_________________。
(3)为确定碱式碳酸铝镁的组成,进行如下实验:
①准确称取3.390g样品与足量稀盐酸充分反应,生成CO20.560L(已换算成标准状况下)。②另取一定量样品在空气中加热,样品的固体残留率(固体样品的剩余质量/固体样品的起始质量×100%)随温度的变化如右图所示(样品在2700C时已完全失去结晶水,6000C以上残留固体为金属氧化物的混合物)。
根据以上实验数据计算碱式碳酸铝镁样品中的n(OH-): n(CO32-)(写出计算过程)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是( )
A.已知Ni(CO)4(s)=Ni(s)+4CO(g)ΔH=Q kJmol﹣1,则:Ni(s) + 4CO(g)=Ni(CO)4(s)ΔH=﹣Q kJmol﹣1
B.在一定温度和压强下,将0.5mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放出热量19.3 kJ,则其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=﹣19.3kJ/mol
2NH3(g) ΔH=﹣19.3kJ/mol
C.已知2H2(g)+O2(g)=2H2O(l)ΔH1,2H2(g)+O2(g)=2H2O(g)ΔH2,则ΔH1>ΔH2
D.已知C(石墨,s)=C(金刚石,s) ΔH>0,则金刚石比石墨稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验分析错误的是![]()
A.用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小
B.用润湿的pH试纸测稀碱溶液的pH,测定值偏小
C.滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小
D.测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度值偏小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com