
 ��
�� ������Ԫ�����Ľṹ��ʽΪ
������Ԫ�����Ľṹ��ʽΪ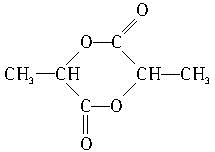 ��
�� ���� ��1����Է�������֮�ȵ����ܶ�֮�ȣ�
��2����ʯ�����ص�����Ϊ������̼��ˮ��������3.00g��ɫ����Ϊ̼��ƣ�
��3���ǻ����Ȼ������Ʒ�Ӧ���Ȼ�����̼���Ʒ�Ӧ��
��4��Ũ������������������ӵ�CH2��OH��CH2COOH�ܷ�Ӧ���ɰ�Ԫ��״�����
��� �⣺��1����Է�������֮�ȵ����ܶ�֮��=$\frac{0.90g}{0.02g}$=45���������Է�������Ϊ90���ʴ�Ϊ��90��
��2��3.00g��ɫ����Ϊ̼��ƣ����ʵ���Ϊ0.03mol����������ʵ���Ϊ0.01mol��0.01mol������ȫȼ������CO2 0.03 mol������H2O��
$\frac{1.86g-0.03mol��44g/mol}{18g/mol}$=0.03 mol������һ�������������3��̼ԭ�Ӻ�6��Hԭ�ӣ���������Է�������Ϊ90���ʺ���ԭ����Ϊ$\frac{90-3��12-6}{16}$=3����������ķ���ʽΪC3H6O3���ʴ�Ϊ��C3H6O3��
��3���ǻ����Ȼ������Ʒ�Ӧ��H2 224mL�����ʵ���Ϊ0.01mol���Ȼ�����̼���Ʒ�Ӧ��112mL CO2�����ʵ���Ϊ0.005mol��˵���ǻ����Ȼ��ĸ�����ȣ������Է�������Ϊ90����֪����Ľṹ��ʽ������CH2��OH��CH2COOH�� ���ʴ�Ϊ��CH2��OH��CH2COOH��
���ʴ�Ϊ��CH2��OH��CH2COOH�� ��
��
��4��Ũ������������������ӵ�CH2��OH��CH2COOH�ܷ�Ӧ���ɰ�Ԫ��״�����Ũ������������������ӵ� �ܷ�Ӧ������Ԫ��״�������û�����Ľṹ��ʽΪ
�ܷ�Ӧ������Ԫ��״�������û�����Ľṹ��ʽΪ ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
�� ��
��
���� ���⿼�����л���ṹ�����ʡ��л���Ӧ����ʽ����д����Ŀ�Ѷ��еȣ�ע�����ճ����л���ṹ�����ʣ��ܹ�������д������Ӧ�Ļ�ѧ����ʽ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��1���ͣ�6�� | B�� | ��3���ͣ�4�� | C�� | ��2���ͣ�5�� | D�� | ��1���ͣ�4�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �۵㣺CO2��H2O��SiO2��KCl | B�� | ��ԭ�ԣ�S2-��I-��Br-��Cl- | ||
| C�� | ���ԣ�H3PO4��H2SO4��HClO4��H2SiO3 | D�� | �ȶ��ԣ�H2O��NH3��PH3��SiH4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NaCl | B�� | C | C�� | Fe | D�� | Ar |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ԭ�����Һ��c��Na+ ��=6mol/L | B�� | ������Һ��c��H+��=4mol/L | ||
| C�� | �����������й�ת��8mol���� | D�� | ����õ���Cu�����ʵ���Ϊ2mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ɡ����ꡱ��������� | B�� | ˮ��Һ�ʼ��� | ||
| C�� | ������Ʒ����Һ��ɫ | D�� | ����ʹ�����ʯ��ˮ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
���� ���� | ��A | ��A | ��A | ��A | ��A | ��A | ��A | 0 |
| 2 | �� | �� | �� | |||||
| 3 | �� | �� | �� | �� | �� | |||
| 4 | �� | �� |
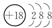 ��
�� 4NO+6H2O��
4NO+6H2O���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
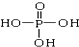 ��
�� ���������Һ��0.1mol•L-1��NaOH��Һ�ζ���������NaOH��Һ 42.00mL��50.00mLʱ����һ���ζ��յ㣮��ش�
���������Һ��0.1mol•L-1��NaOH��Һ�ζ���������NaOH��Һ 42.00mL��50.00mLʱ����һ���ζ��յ㣮��ش��鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com