
| A. | (1)和(6) | B. | (3)和(4) | C. | (2)和(5) | D. | (1)和(4) |
分析 如离子之间不发生复分解反应生成沉淀、气体、水或不发生氧化还原反应、互促水解反应,则可大量共存,结合题中离子的性质解答.
解答 解:(1)Fe2+、ClO-发生氧化还原反应而不能大量共存,故错误;
(2)Al3+、HCO3-发生互促水解反应而不能大量共存,故错误;
(3)离子之间不发生任何反应,可大量共存,故正确;
(4)离子之间不发生任何反应,可大量共存,故正确;
(5)AlO2-、HCO3-发生反应生成氢氧化铝和碳酸根离子,不能大量共存,故错误;
(6)Ca2+与SO42-、CO32-反应生成沉淀而不能大量共存,故错误.
故选B.
点评 本题考查离子共存问题,为高频考点,侧重于学生的分析能力和元素化合物知识的综合理解和运用的考查,注意把握题给信息以及常见离子的性质以及反应类型的判断,难度不大.


科目:高中化学 来源: 题型:多选题
 某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示.据图分析,下列判断正确的是( )
某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示.据图分析,下列判断正确的是( )| A. | Ksp[Fe(OH)3]<Ksp[Cu(OH)2] | |
| B. | 加适量NH4Cl固体可使溶液由a点变到b点 | |
| C. | 对a、b两点的Ksp前者大于后者 | |
| D. | Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCO3-离子略多于CO32-离子 | |
| B. | HCO3-离子等于CO32-离子 | |
| C. | HCO3-离子略少于CO32-离子 | |
| D. | Na+离子数等于HCO3-和CO32-离子数之和 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实 实验步骤 | 预期现象与结论 |
| 步步骤1:取2mLFeSO4溶液和2mLKI溶液混合于试管中,再滴加再滴加几滴氯水. | 溶 溶液变成黄色,推测有Fe3+或I2生成. |
| 步骤2:向试管中继续滴加几滴20%KSCN溶液或向试管中继续滴加几滴淀粉溶液 | 溶液不变红,说明I-的还原性强于Fe2+或溶液变蓝,说明I-的还原性强于Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2O3和CO2是同素异形体 | B. | C2O3和CO完全燃烧,产物都是CO2 | ||
| C. | C2O3和CO 都是酸性氧化物 | D. | C2O3和CO2都是碳酸的酸酐 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 实验操作 | 预期现象和结论 |
| ① | ||
| ② | ||
| ③ | ||
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
; ,该六元环酯的结构简式为
,该六元环酯的结构简式为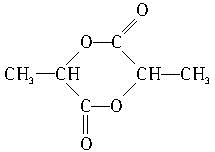 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com