
【题目】亚硝酸钙[Ca(NO2)2]是水泥混凝土外加剂的主要原料,某学习小组设计实验制备亚硝酸钙,实验装置如图所示(夹持装置略去):
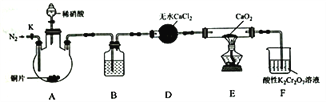
已知:2NO+CaO2 =Ca(NO2)2;2NO2+CaO2=Ca(NO3)2。
请回答下列问题:
(1)将分液漏斗中的稀硝酸滴入三颈烧瓶中的操作为______________。
(2)向三颈烧瓶中加入稀硝酸之前,应向装置中通入一段时间的N2,原因为_________________。
(3)装置D中的仪器名称为_______________。装置B所加试剂为_______________。
(4)装罝F中,酸性K2Cr2O7溶液可将剩余的NO氧化为NO3-,溶液由橙色变为绿色(Cr3+),发生反应的离子方程式为_________________。
(5)已知:Ca(NO2)2溶液遇酸会产生NO气体。设计实验证明装置E中有亚硝酸钙生成:____________。
(6)工业上可用石灰乳和硝酸工业的尾气(含NO、NO2)反应,既能净化空气,又能获得应用广泛的 Ca(NO2)2,反应原理为Ca(OH)2 + NO+NO2=Ca(NO2)2 + H2O。
①若n(NO):n(NO2)>l:l,则会导致______________________________。
②若n(NO):n(NO2)<1:1,则会导致________________________________。
【答案】 打开分液漏斗的玻璃塞(或将玻璃塞的凹槽与分液漏斗口的小孔对齐),打开分液漏斗的活塞,控制稀硝酸以一定速度滴入三颈烧瓶 排出装置中的空气,防止空气中的氧气将NO氧化为NO2 (球形)干燥管 蒸馏水 Cr2O72-+2NO+6H+=2Cr3++2NO3-+3H2O 取少量装置E中反应后的固体于洁净的试管中,滴加适量稀硫酸,试管口有红棕色气体产生,则装置E中有亚硝酸钙生成 排放NO气体,污染环境 产品中混有Ca(NO3)2杂质
【解析】(1)用分液漏斗向其他仪器中滴加液体时,需要使分液漏斗内压强与外界大气压相等以保证液体容易顺利滴下,同时需要控制液体流速,因此正确的操作为:打开分液漏斗的玻璃塞(或将玻璃塞的凹槽与分液漏斗口的小孔对齐),然后再打开分液漏斗的活塞,控制稀硝酸以一定速度滴入三颈烧瓶;(2)制备亚硝酸钙所需的反应物为CaO2和NO,其中NO易被空气中的氧气氧化,所以需先排除装置中的空气;(3)根据装置图可知装置D中的仪器名称为干燥管。该装置中,装置D为干燥装置,则装置B所加液体试剂为除杂试剂,根据稀硝酸的性质,其与铜反应放热,容易挥发出一定量的硝酸,同时也需将硝酸受热分解产生的NO2转化为NO,所以可以用蒸馏水。(4)结合酸性介质,依据电子得失守恒、电荷守恒以及原子守恒可知发生反应的离子方程式为Cr2O72-+2NO+6H+=2Cr3++2NO3-+3H2O。(5)已知亚硝酸钙遇酸发生反应,产生NO气体,NO与氧气生成红棕色NO2,所以证明装置E中有亚硝酸钙生成的实验方案为:取少量装置E中反应后的固体于洁净的试管中,滴加适量稀硫酸,试管口有红棕色气体产生,则装置E中有亚硝酸钙生成。(6)①n(NO):n(NO2)>l:l时,NO过量,而NO不与氢氧化钙溶液反应,会导致环境污染;②n(NO):n(NO2)<1:1时,NO2过量,NO2与氢氧化钙溶液反应生成亚硝酸钙和硝酸钙,会导致产品中混有硝酸钙杂质。


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:
【题目】下列关于金属腐蚀的叙述正确的是
A. 金属(M表示金属) 被腐蚀的本质是: M n+ + ne- = M
B. 金属不可能在碱性环境中发生电化学腐蚀
C. 镀锌铁的镀层破损后,镀层仍能对铁起保护作用
D. 钢管与外加直流电源的正极相连,以保护它不受腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界为人类提供了多种多样的营养物质,下列有关营养物质的说法正确的是
A. 蔗糖、淀粉、油脂等都可以发生水解反应
B. 摄入人体的纤维素在酶的作用下能水解为葡萄糖
C. 糖类、蛋白质、油脂都属于天然高分子化合物
D. 所有糖类物质都有甜味,但不一定都溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】印刷电路板在科技领域具有不可替代的作用,它的制备方法为高分子化合物和铜箔压合,通过FeCl3溶液“腐蚀”而成。某实验小组在实验室用废弃的印刷电路板和“腐蚀液”提取铜的一种工艺流程如下:
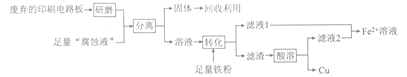
请回答下列问题:
(1) 检验“腐蚀液”中含有Fe2+的方法为_________________。
(2)“分离”所用的操作名称为____________,该操作所用的主要玻璃仪器有烧杯、_____________。
(3)用电解法在铁上镀铜时,阴极材料为_____________(填化学式),理论上电镀过程中电解质溶液的浓度_______________ (填“增大”“减小”或“不变”)。
(4) Fe2+溶液有很多重要用途。
①已知:常温下,Ksp[Fe(OH)2]=1.8×10-16。保存1.8mol·L-1的FeSO4溶液时,为确保溶液中不出现浑浊,应调节溶液的pH不超过_________________。
②Fe2+可使Ag+与Fe3+之间相互转化。一定温度下,0.1 mol·L-1的Fe(NO3)2溶液中,c(Fe3+)与c(Ag+)的关系如图所示:
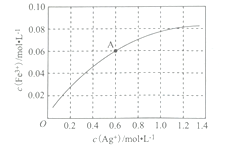
该温度下,A点溶液中转化反应的平衡常数为____________(溶液体积变化忽略不计);若将0.6mol·L-1 Fe(NO3)2溶液、0.15 mol·L-1 Fe(NO3)3溶液、0.06 mol L-1 AgNO3溶液等体积混合后,再加入1.08 g Ag,可观察到的现象为_________________________。
③Fe2+转化为Fe3+后,可用于制备高铁酸盐。向FeCl3溶液中加入NaOH、NaClO溶液制备Na2FeO4的化学方程式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于氨基酸的叙述错误的是( )
A. 氨基酸的结构中都含有氨基和羧基
B. 人体内氨基酸代谢的最终产物是二氧化碳和尿素
C. 人体内所有氨基酸都可以相互转化
D. 两个氨基酸通过脱水缩合形成二肽
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 液态HCl不导电,所以HCl是非电解质
B. NH3的水溶液能导电,所以NH3是电解质
C. 铜、石墨均能导电,所以它们都是电解质
D. 蔗糖在水溶液中和熔融时都不导电,所以是非电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
①向某溶液中加入BaCl2溶液,生成白色沉淀,再加盐酸,沉淀不溶解,则原溶液中一定有SO42-
②向某溶液中加入CCl4,CCl4层显紫红色,证明该溶液中存在I-
A. 只有① B. 只有② C. ① ② D. 都不对
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 化学反应中的能量变化,通常表现为热量的变化
B. 反应物的总能量高于生成物的总能量时发生吸热反应
C. Ba(OH)28H2O与NH4Cl的反应是放热反应
D. 木炭在氧气中的燃烧是吸热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com