
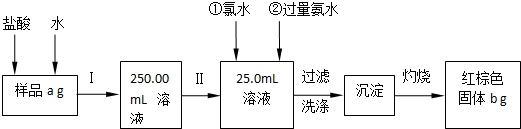
| ||
| 50g |


 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
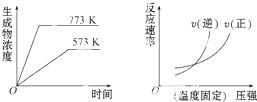
| A、N2(g)+3H2(g)?2NH5(g)△H=-Q1kJ?mol-1(Q1>0) |
| B、2SO5(g)?2SO2(g)+O2(g)△H=+Q2kJ?mol-1(Q2>0) |
| C、4NH5(g)+5O2(g)?4NO(g)+6H2O(g)△H=-Q3kJ?mol-1(Q3>0) |
| D、H2(g)+CO(g)?C(g)+H2O(g)△H=+Q4kJ?mol-1(Q4>0) |
查看答案和解析>>
科目:高中化学 来源: 题型:
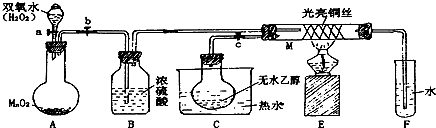
查看答案和解析>>
科目:高中化学 来源: 题型:
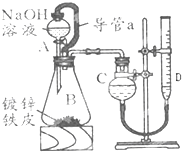 “白铁皮”即镀锌铁皮,镀锌层犹如铁皮的保护层,具有较强的耐腐蚀性,这层膜的厚度是判断白铁皮质量的重要指标,某研究性学习小组为了测定镀膜厚度,设计了下面的实验方案.
“白铁皮”即镀锌铁皮,镀锌层犹如铁皮的保护层,具有较强的耐腐蚀性,这层膜的厚度是判断白铁皮质量的重要指标,某研究性学习小组为了测定镀膜厚度,设计了下面的实验方案.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 |
| B、不慎将碱液沾带皮肤上,要立即用大量水冲洗,然后涂上硼酸 |
| C、酒精灯着火时,用湿抹布盖灭 |
| D、稀释浓硫酸时,可向盛浓硫酸的烧杯中小心注入蒸馏水,边加边搅拌 |
查看答案和解析>>
科目:高中化学 来源: 题型:
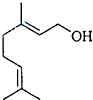
| A、香叶醇的分子式为C10H20O |
| B、不能使溴的四氯化碳溶液褪色 |
| C、不能发生催化氧化反应生成醛 |
| D、既能发生加成反应又能发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、a=-23.1kJα=40% |
| B、a=-23.1kJ α=25% |
| C、a=+23.1kJα=40% |
| D、a=+23.1kJ α=25% |
查看答案和解析>>
科目:高中化学 来源: 题型:
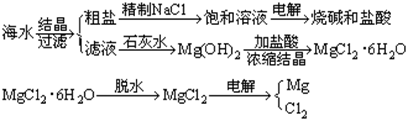
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com