
【题目】常温下,向![]() 氨水中滴加盐酸,溶液中水电离出的氢离子浓度随加入盐酸体积的变化如图所示.下列说法错误的是
氨水中滴加盐酸,溶液中水电离出的氢离子浓度随加入盐酸体积的变化如图所示.下列说法错误的是 ![]()
![]()
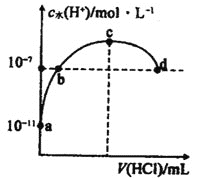
A.c点表示氨水与盐酸恰好完全反应
B.b点溶液呈中性,d点溶液呈酸性
C.常温下,![]() 的数量级为
的数量级为![]()
D.a、b之间的任意一点(不包括a、b点)溶液中:![]()
科目:高中化学 来源: 题型:
【题目】已知C、D、G、I为短周期元素形成的单质,D、G、I常温下为气态,且G为黄绿色;形成D的元素原子的最外层电子数是次外层的3倍;B的焰色反应呈紫色(透过蓝色钴玻璃);K为红棕色粉末。其转化关系如图。

请回答:
(1)工业上制C用A不用H的原因 。
(2)写出C与K反应的化学方程式 ,该反应的反应物总能量 (填“大于”或“小于”)生成物总能量。
(3)L是目前应用最广泛的金属,用碳棒作阳极,L作阴极,接通电源(短时间)电解E水溶液的化学方程式 。
(4)写出E物质的电子式 。
(5)J与H反应的离子方程式为 。
(6)写出G与熟石灰反应制取漂白粉的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(Ⅰ)工业尾气SO2、NO2是污染大气、形成酸雨的罪魁祸首。请回答下列问题:异氰酸(化学式:HNCO,C为+4价)可用于消除尾气中的NO2。其反应原理为:HNCO+NO2→N2+CO2+![]() (未配平)。
(未配平)。
①上述反应的氧化剂是____________。
②配平后方框内应填写____________。
③每处理33.6LNO2(标准状况),反应中转移电子的数目为____________。
(Ⅱ)为了减少CO对大气的污染,某研究性学习小组拟研究利用CO和H2O反应转化为绿色能源H2.已知:2CO(g)+O2(g)═2CO2(g)△H=﹣566.0kJ mol﹣1;2H2(g)+O2(g)═2H2O(g)△H=﹣483.6kJ mol﹣1;2H2O(g)═H2O(l)△H=﹣44.0kJ mol﹣1。
(1)写出CO和H2O(g)作用生成CO2和H2的热化学方程式:____________。
(2)氢气是合成氨的重要原料,合成氨反应的热化学方程式如下:N2(g)+3H2(g)![]() 2NH3(g)△H=﹣92.4kJmoL﹣1。
2NH3(g)△H=﹣92.4kJmoL﹣1。
①当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如图所示.图中t3时引起平衡移动的条件可能是______,其中表示平衡混合物中NH3的含量最高的一段时间是______。

②温度为T℃时,将1mol N2和2mol H2放入容积为0.5L的密闭容器中,充分反应后测得N2的平衡转化率为50%.则反应在T℃时的平衡常数为______mol﹣2L2。
③目前工业合成氨的原理是:N2+3H2![]() 2NH3如图表示随条件改变,平衡体系中氨气体积分数的变化趋势,当横坐标为压强时,变化趋势正确的是(填序号,下同)___,当横坐标为温度时,变化趋势正确的是___。
2NH3如图表示随条件改变,平衡体系中氨气体积分数的变化趋势,当横坐标为压强时,变化趋势正确的是(填序号,下同)___,当横坐标为温度时,变化趋势正确的是___。

(3)常温下氨气和HCl均极易溶于水,现将相同体积、相同物质的量浓度的氨水和盐酸混合,所得溶液中各离子的物质的量浓度按照由大到小的顺序排列依次为____>____>____>____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成氨反应在催化剂表面的反应历程及能量变化如图所示,下列说法正确的是
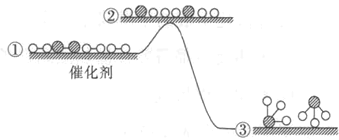
A.增大压强,①→②之间的能量差值会增大
B.合成氨的正逆反应的焓变相同
C.合成氨的过程是吸热反应
D.若使用催化剂,生成等量的NH3需要的时间更短
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、W均为中学常见的纯净物,它们之间有如下转化关系(其他产物及反应条件已略去,反应可以在水溶液中进行):![]() 。三种物质的焰色反应均为黄色;C常作面包和糕点的发泡剂,受热分解可生成B。
。三种物质的焰色反应均为黄色;C常作面包和糕点的发泡剂,受热分解可生成B。
(1)写出下列物质的化学式A______,B________,C________,W________。
(2)写出A溶液与C溶液反应的离子方程式为_______________________________。
(3)向两份30 mL同浓度的A溶液中通入不同体积的W气体,得到溶液M、N。向M、N溶液中逐滴加入浓度为0.25 mol·L-1盐酸,如图所示Ⅰ和Ⅱ分别为加入V(盐酸)与产生V(W)的关系。通过计算确定A溶液的物质的量浓度为 _______________。

(4)M、N两溶液中相同溶质的物质的量之比为多少_______?(写出必要的文字说明和计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的工业硫酸盐废水中含有大量的Fe2+、Fe3+、较多的Cu2+和少量的Na+。工厂计划从该废水中回收硫酸亚铁和金属铜,设计如下流程图。

回答下列问题;
(1)A的化学式为_________,D的化学式为_______。
(2)在工业废水中加入过量A时,发应的离子方程式有:___________、__________。
(3)得到FeSO47H2O晶体的操作Ⅲ为:加热浓缩、冷却结晶、______、______、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一个电化学过程的示意图如图所示。

请回答下列问题:
(l)通入CH3CH2OH一极的电极反应式为__________________________。
(2)乙池是铜的精炼池,则A电极的材料是_____________;反应一段时间后,乙池溶液中c(Cu2+)__________(填“增大”“变小”或“不变”)。
(3)丙池含有0.01 mol KCl的溶液100mL,假如电路中转移了0.03 mol e-,则阳极产生的气体在标准状况下的体积是________。
(4)丙池中滴有酚酞,实验开始后观察到的现象是_______________________________,写出丙池的总反应方程式:________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2010年,中国首次应用六炔基苯在铜片表面合成了石墨炔薄膜(其合成示意图如右图所示),其特殊的电子结构将有望广泛应用于电子材料领域。下列说法不正确的是( )
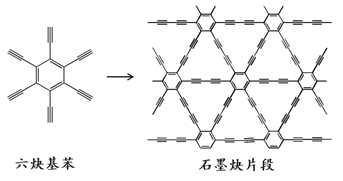
A.六炔基苯的化学式为C18H6
B.六炔基苯和石墨炔都具有平面型结构
C.六炔基苯和石墨炔都可发生加成反应
D.六炔基苯合成石墨炔属于加聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在500 mL KNO3和Cu(NO3)2的混合溶液中,c(NO3-)=6 mol/L,用石墨电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是
A. 电解得到的Cu的物质的量为0.5 mol
B. 向电解后的溶液中加入98 g的Cu(OH)2可恢复为原溶液
C. 原混合溶液中c(K+)=4 mol/L
D. 电解后溶液中c(H+)=2 mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com