
【题目】工业合成氨反应在催化剂表面的反应历程及能量变化如图所示,下列说法正确的是
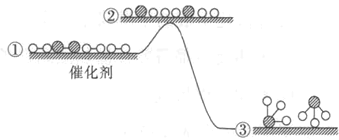
A.增大压强,①→②之间的能量差值会增大
B.合成氨的正逆反应的焓变相同
C.合成氨的过程是吸热反应
D.若使用催化剂,生成等量的NH3需要的时间更短
科目:高中化学 来源: 题型:
【题目】一氯甲烷等卤代烃跟苯的反应如图所示,(无机小分子产物略去)。下列说法正确的是

A. 该反应属于化合反应
B. b的二氯代物有6种结构
C. 1mol b加氢生成饱和烃需要6molH2
D. C5H11Cl的结构有8种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机化合物与金属钠反应放出氢气,充分燃烧8.88 g该有机物,将燃烧后的气体通入浓硫酸,浓硫酸质量增加10.8 g;将剩余气体通入NaOH溶液,溶液质量增加21.12 g。由质谱仪测得此种有机物的相对分子质量为74。该有机物在浓硫酸的作用下发生消去反应时能生成两种有机产物。则该有机物可能的结构简式为 ( )
A. CH3CH2CH2CH2OH
B. CH3CH2CHOHCH3
C. (CH3)2CHCH2OH
D. (CH3)3COH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】这次中美贸易战的矛盾激化,也让我们看到了中国半导体产业存在的诸多不足,俗话说“亡羊补牢,为时未晚”,找出存在的不足,然后针对地去解决问题,才能让半导体产业链发展壮大起来。三氯化氧磷(POCl3)是一种重要的化工原料,常用作半导体掺杂剂及光导纤维原料。一研究小组在实验室模拟反应![]() 制备POCl3并测定产品含量。
制备POCl3并测定产品含量。
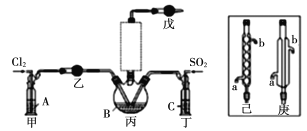
资料卡片:
物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其他 |
PCl3 | -93.6 | 76.1 | 137.5 | 遇水剧烈水解,易与O2反应 |
POCl3 | 1.25 | 105.8 | 153.5 | 遇水剧烈水解,能溶于PCl3 |
SOCl2 | -105 | 78.8 | 119 | 遇水剧烈水解,受热易分解 |
(1)若选用Na2SO3固体与70%浓H2SO4制取SO2,反应的化学方程式是:____________。
(2)溶液A为饱和食盐水,乙装置中应该盛装的试剂为__________(填“P2O5”或“碱石灰”或“浓H2SO4”或“无水硫酸铜”);反应装置图的虚框中未画出的仪器最好选择______(填“己”或“庚”)。
(3)甲、丁装置的作用除了用于气体的净化除杂外,还有________________。
(4)水浴加热三颈烧瓶,控制反应温度在60~65℃,其原因是___________。
(5)通过佛尔哈德法可测定经过提纯后的产品中POCl3的含量:准确称取1.600g样品在水解瓶中摇动至完全水解,将水解液配成100 mL溶液,取10.00 mL于锥形瓶中,加入0.2000 mol·L-1的AgNO3溶液20.00 mL(Ag++C1- AgC1↓),再加少许硝基苯,用力振荡,使沉淀被有机物覆盖。加入NH4Fe(SO4)2作指示剂,用0.1000 mol·L-1KSCN标准溶液滴定过量的AgNO3至终点(Ag++SCN- AgSCN↓),做平行实验,平均消耗KSCN标准溶液10.00 mL。
①达到滴定终点的现象是____________。
②POCl3的质量分数为___________。
③已知:KSP(AgC1)=3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施或事实不能用勒夏特列原理解释的是
A.新制的氯水在光照下颜色变浅
B.H2、I2、HI平衡混合气加压后颜色变深
C.在合成氨的反应中,加压有利于氨的合成
D.Fe(SCN)3溶液中加入NaOH后溶液颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应过程中的能量变化如图所示,下列说法中正确的是
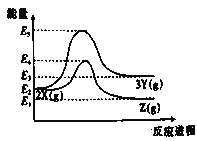
A.定容容器中,平衡体系2X(g)→3Y(g)中,增加X的量,平衡时X的百分含量升高
B.反应2X(g)→Z(g)和反应Z(g) →2X(g)的活化能相等,焓变不同
C.图示中的两个反应都是放热反应
D.升高温度,有利于反应2X(g)→3Y(g)正向进行,正反应速率增大,逆反应速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向![]() 氨水中滴加盐酸,溶液中水电离出的氢离子浓度随加入盐酸体积的变化如图所示.下列说法错误的是
氨水中滴加盐酸,溶液中水电离出的氢离子浓度随加入盐酸体积的变化如图所示.下列说法错误的是 ![]()
![]()
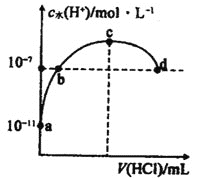
A.c点表示氨水与盐酸恰好完全反应
B.b点溶液呈中性,d点溶液呈酸性
C.常温下,![]() 的数量级为
的数量级为![]()
D.a、b之间的任意一点(不包括a、b点)溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:
(1)准确称量8.2 g含有少量中性易溶杂质的样品,配成500 mL待测溶液。称量时,样品可放在________(填字母)称量。
A.小烧杯中 B.洁净纸片上 C.托盘上
(2)滴定过程中,眼睛应注视________________。滴定时,用0.2000molL-的盐酸来滴定待测液,不可选用______(填编号字母)作指示剂。
A.甲基橙 B.石蕊 C.酚酞
(3)滴定时,用0.200 0 mol·L-1的盐酸来滴定待测溶液,根据下表数据,计算被测烧碱溶液的物质的量浓度是________ mol·L-1,烧碱样品的纯度是________。
滴定次数 | 待测溶液体积(mL) | 标准酸体积 | |
滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
第一次 | 10.00 | 0.40 | 20.50 |
第二次 | 10.00 | 4.10 | 24.00 |
(4)下列实验操作会对滴定结果产生什么后果?(填“偏高”、“偏低”或“无影响”)
①若将锥形瓶用待测液润洗,然后加入10.00mL待测液,则滴定结果______
②若锥形瓶未干燥就加入10.00mL待测液,则滴定结果______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为减少交通事故,新交规明令禁止酒后驾车并对酒后驾车行为予以重罚。为检验驾驶员是否酒后驾车,可采用的检验方法有多种。回答以下问题:
(1)早期曾经采用五氧化二碘和某种高分子化合物X的混合溶液来检测酒精的存在。理是:I2O5与CH3CH2OH先发生反应(I2O5+5CH3CH2OH=I2+5Y+5H2O),生成的I2与高分子化合物X作用而变蓝。交警依据此原理来检测驾驶员是否饮酒。则:X的化学式是_____________;Y的化学式是_________;
(2)已知:I2O5是白色固体,可用于检验并定量测定空气中CO;两者在常温条件下发生的反应为5CO+I2O5=5CO2+I2(空气中其余气体不与I2O5反应);某同学设计如图实验装置完成上述目的。
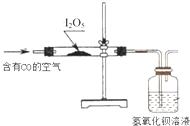
①指出能证明空气中有CO存在的现象:_____________。
②将上述反应生成的碘单质用硫代硫酸钠滴定(反应为I2+2Na2S2O3=Na2S4O6+2NaI),即可根据消耗硫代硫酸钠的量来计算空气中CO的含量。若某次实验时测得参与反应的空气体积为a mL(标准状况下),滴定过程中,共消耗vmLcmol·L﹣1Na2S2O3溶液,则该空气样品中CO的体积分数是________。
③有同学提出只要依据参与反应的空气体积和洗气瓶中白色沉淀的质量也可求得空气中CO。此方案是否可行?_________。
(3)燃料电池酒精检测仪(该电池以硫酸溶液为电解质溶液)也是检测酒精含量的一种方法。总反应是:CH3CH2OH+O2=CH3COOH+H2O。该电池负极电极反应式是________________。
(4)酒精是一种较为环保的燃料,298K时,1g乙醇完全燃烧放出热量qkJ,写出乙醇燃烧的热化学方程式________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com