
【题目】一个电化学过程的示意图如图所示。

请回答下列问题:
(l)通入CH3CH2OH一极的电极反应式为__________________________。
(2)乙池是铜的精炼池,则A电极的材料是_____________;反应一段时间后,乙池溶液中c(Cu2+)__________(填“增大”“变小”或“不变”)。
(3)丙池含有0.01 mol KCl的溶液100mL,假如电路中转移了0.03 mol e-,则阳极产生的气体在标准状况下的体积是________。
(4)丙池中滴有酚酞,实验开始后观察到的现象是_______________________________,写出丙池的总反应方程式:________________________________________。
【答案】CH3CH2OH-12e-+16OH-=2CO32-+11H2O 纯铜 减小 224mL 两电极均有气泡冒出,左电极附近溶液变红 2KCl+2H2O ![]() 2KOH+H2↑+Cl2↑
2KOH+H2↑+Cl2↑
【解析】
(l) 乙醇中C元素的化合价升高,则通入CH3CH2OH的电极为负极,失去电子发生氧化反应;
(2) 乙中A与负极相连,则A为阴极,粗铜精炼粗铜为阳极,纯铜作阴极,电解质为可溶性铜盐;
(3)丙池中用惰性电极电解含有0.01 mol KCl的溶液100mL,阳极上先后发生2Cl--2e-=Cl2↑、4OH--4e-=2H2O+O2↑,当电路中转移了0.03 mol e-时结合电子守恒计算阳极产生的氯气和氧气的总体积;
(4) 电解氯化钾溶液,生成氢气、氯气和氢氧化钾,溶液呈碱性。
(l) 乙醇中C元素的化合价升高,则通入CH3CH2OH的电极为负极,失去电子发生氧化反应,电极反应为CH3CH2OH-12e-+16OH-=2CO32-+11H2O;
(2) 乙中A与负极相连,则A为阴极,粗铜精炼粗铜为阳极,则A为纯铜,电解质为可溶性铜盐,可选硫酸铜溶液,因阳极溶解的是Cu和比Cu活泼的金属,而阴极析出的金属为Cu,由电子守恒可知,溶解的Cu和析出的Cu质量不等,则反应一段时间后,乙池溶液中c(Cu2+)减小;
(3) 丙池中用惰性电极电解含有0.01 mol KCl的溶液100mL,阳极上先后发生2Cl--2e-=Cl2↑、4OH--4e-=2H2O+O2↑,则当电路中转移了0.03 mol e-时,溶液中的Cl-完全氧化为氯气,得到0.005mol Cl2,由电子守恒可知,同时生成O2的物质的量为![]() =0.005mol,混合气体的总物质的量为0.005mol+0.005mol=0.01mol,在标准状况下的体积为0.01mol×22.4L/mol=0.224L=224mL;
=0.005mol,混合气体的总物质的量为0.005mol+0.005mol=0.01mol,在标准状况下的体积为0.01mol×22.4L/mol=0.224L=224mL;
(4) 电解氯化钾溶液,生成氢气、氯气和氢氧化钾,溶液呈碱性,可观察到两电极均有气泡冒出,左电极为阴极,氢离子放电后,阴极附近溶液呈碱性,溶液变红,电解总反应式为2KCl+2H2O ![]() 2KOH+H2↑+Cl2↑。
2KOH+H2↑+Cl2↑。


科目:高中化学 来源: 题型:
【题目】(1)合成氨工业生产中所用的αFe催化剂的主要成分是FeO、Fe2O3。
①某FeO、Fe2O3混合物中,铁原子、氧原子的物质的量之比为4∶5,其中FeO、Fe2O3的物质的量之比为____。
②当催化剂中+2价Fe与+3价Fe的物质的量之比为1∶2时,其催化活性最高,此时铁的氧化物的混合物中铁原子的质量分数为____ (用小数表示,保留2位小数)。
(2)电子工业常用30%的FeCl3溶液腐蚀绝缘板上的铜箔,制造印刷电路板。
①用FeO稀盐酸、氯气制取FeCl3溶液的离子方程式为____、____。检验溶液中Fe3+的试剂是____。
②写出FeCl3溶液与金属铜发生反应的化学方程式:____,当转移电子数为6.02×1024时,被氧化的物质的质量为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施或事实不能用勒夏特列原理解释的是
A.新制的氯水在光照下颜色变浅
B.H2、I2、HI平衡混合气加压后颜色变深
C.在合成氨的反应中,加压有利于氨的合成
D.Fe(SCN)3溶液中加入NaOH后溶液颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向![]() 氨水中滴加盐酸,溶液中水电离出的氢离子浓度随加入盐酸体积的变化如图所示.下列说法错误的是
氨水中滴加盐酸,溶液中水电离出的氢离子浓度随加入盐酸体积的变化如图所示.下列说法错误的是 ![]()
![]()
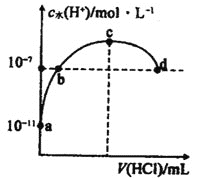
A.c点表示氨水与盐酸恰好完全反应
B.b点溶液呈中性,d点溶液呈酸性
C.常温下,![]() 的数量级为
的数量级为![]()
D.a、b之间的任意一点(不包括a、b点)溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2 L的密闭容器中加入2 mol X和3 mol Y,发生如下反应:2X(g)+3Y(g)![]() 4Z(g)+W(g) △H<0,反应10 min后达到平衡,此时W的浓度为0.25 mol·L-1。下列说法正确的是
4Z(g)+W(g) △H<0,反应10 min后达到平衡,此时W的浓度为0.25 mol·L-1。下列说法正确的是
A.前5min内,反应的平均速率v(Z)=0.1 mol·L-1·min-1
B.其他条件不变时,将反应容器的体积缩小一半,W的平衡浓度为0.5 mol·L-1
C.保持温度不变,10 min后向容器中再加入1 mol X和1.5 mol Y,重新达到平衡时,X的转化率大于50%
D.若反应在绝热容器中进行,其他条件不变,反应达到平衡时Y的浓度小于0.75 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:
(1)准确称量8.2 g含有少量中性易溶杂质的样品,配成500 mL待测溶液。称量时,样品可放在________(填字母)称量。
A.小烧杯中 B.洁净纸片上 C.托盘上
(2)滴定过程中,眼睛应注视________________。滴定时,用0.2000molL-的盐酸来滴定待测液,不可选用______(填编号字母)作指示剂。
A.甲基橙 B.石蕊 C.酚酞
(3)滴定时,用0.200 0 mol·L-1的盐酸来滴定待测溶液,根据下表数据,计算被测烧碱溶液的物质的量浓度是________ mol·L-1,烧碱样品的纯度是________。
滴定次数 | 待测溶液体积(mL) | 标准酸体积 | |
滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
第一次 | 10.00 | 0.40 | 20.50 |
第二次 | 10.00 | 4.10 | 24.00 |
(4)下列实验操作会对滴定结果产生什么后果?(填“偏高”、“偏低”或“无影响”)
①若将锥形瓶用待测液润洗,然后加入10.00mL待测液,则滴定结果______
②若锥形瓶未干燥就加入10.00mL待测液,则滴定结果______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学欲证明乙炔能与高锰酸钾酸性溶液反应,实验方案如下:将电石与水反应生成的气体通入高锰酸钾酸性溶液,溶液褪色,证明二者发生了反应.请回答:
(1)制备乙炔的反应的化学方程式是______________。
(2)该同学的实验方案存在的问题是______________。
(3)为了解决上述问题,需重新选择实验装置,备选装置如图所示.

①将装置编号按顺序填在横线上_____→B→_____。
②B装置中所盛放的试剂是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】油脂是人类日常生活中必不可少的营养物质,油脂的主要成分是高级脂肪酸甘油酯。常见的高级脂肪酸有硬脂酸、软脂酸、油酸和亚油酸四种,现将这四种酸与甘油混合加热,生成混甘油酯的种类有(不考虑立体异构)(已知:结构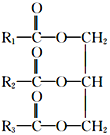 中,R1、R2、R3相同的为单甘油酯,R1、R2、R3不完全相同的为混甘油酯)
中,R1、R2、R3相同的为单甘油酯,R1、R2、R3不完全相同的为混甘油酯)
A. 28种 B. 32种 C. 36种 D. 40种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中所示的装置图能够达到实验目的是( )
A. 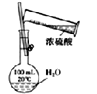 配制一定浓度的稀硫酸
配制一定浓度的稀硫酸
B. 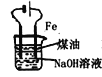 实验室制备Fe(OH)2
实验室制备Fe(OH)2
C. 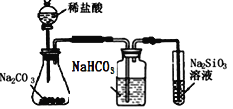 比较氯、碳、硅三种元素的非金属性强弱
比较氯、碳、硅三种元素的非金属性强弱
D.  加热熔融NaOH固体
加热熔融NaOH固体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com