
����Ŀ����1���ϳɰ���ҵ���������õ���Fe��������Ҫ�ɷ���FeO��Fe2O3��
��ijFeO��Fe2O3������У���ԭ�ӡ���ԭ�ӵ����ʵ���֮��Ϊ4��5������FeO��Fe2O3�����ʵ���֮��Ϊ____��
�ڵ�������+2��Fe��+3��Fe�����ʵ���֮��Ϊ1��2ʱ�����������ߣ���ʱ����������Ļ��������ԭ�ӵ���������Ϊ____ (��С����ʾ������2λС��)��
��2�����ӹ�ҵ����30%��FeCl3��Һ��ʴ��Ե���ϵ�ͭ��������ӡˢ��·�塣
����FeOϡ���ᡢ������ȡFeCl3��Һ�����ӷ���ʽΪ____��____��������Һ��Fe3+���Լ���____��
��д��FeCl3��Һ�����ͭ������Ӧ�Ļ�ѧ����ʽ��____����ת�Ƶ�����Ϊ6.02��1024ʱ�������������ʵ�����Ϊ____��
���𰸡�2��1 0.72 FeO+2H+=Fe2++H2O 2Fe2++Cl2=2Fe3++2Cl- KSCN��Һ 2FeCl3+Cu=2FeCl2+CuCl2 320g
��������
��1������FeO��Fe2O3���ʵ����ֱ�Ϊx��y�����������������ʵ���֮��Ϊ4��5�ã�(x+2y)��(x+3y)=4��5�����x��y=2��1���ʴ�Ϊ��2��1��
��������к�1molFeO��1molFe2O3�����������ԭ�����ʵ���Ϊ1mol+2mol=3mol����ԭ�����ʵ���Ϊ1mol+3mol=4mol���ʴ�����FeԪ����������Ϊ(3mol��56g/mol)/(3mol��56g/mol+4mol��16g/mol)��100%=72%=0.72���ʴ�Ϊ��0.72��
��2�����������������ᷴӦ�����Ȼ�������ˮ�������������ᷴӦ�����Ȼ�����ˮ���Ȼ�������������Ӧ�����Ȼ�������Ӧ�����ӷ���ʽ�ֱ�Ϊ��FeO+2H+=Fe2++H2O��Fe2O3+6H+=2Fe3++3H2O��2Fe2++Cl2=2Fe3++2Cl-�����������������������������Ѫ��ɫ����������KSCN��Һ�������������ӵĴ��ڣ��ʴ�Ϊ��FeO+2H+=Fe2++H2O��2Fe2++Cl2=2Fe3++2Cl-��KSCN��Һ��
���Ȼ�����ͭ��Ӧ�����Ȼ��������Ȼ�ͭ����Ӧ�Ļ�ѧ����ʽΪ��2FeCl3+Cu=2FeCl2+CuCl2�����ݻ�ѧ����ʽ��֪��ת��2mol���ӱ�������ͭ������Ϊ64g����ת�Ƶ�����Ϊ6.02��1024ʱ�������ʵ���Ϊ10molʱ����������ͭ������Ϊ64g/mol��![]() mol=320g���ʴ�Ϊ��320g��
mol=320g���ʴ�Ϊ��320g��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������CH4������NO2����Ⱦ����Ӧԭ��Ϊ��CH4(g)+2NO2(g)![]() N2(g) + CO2(g) +2H2O(g)����10L�ܱ������зֱ����0.50mol CH4��1.2molNO2����ò�ͬ�¶���n(CH4)��ʱ��仯���й�ʵ�����������ʾ��
N2(g) + CO2(g) +2H2O(g)����10L�ܱ������зֱ����0.50mol CH4��1.2molNO2����ò�ͬ�¶���n(CH4)��ʱ��仯���й�ʵ�����������ʾ��

����˵����ȷ����
A.������0 ~20 min�ڣ�NO2��������Ϊ0.0125molL��1min��1
B.��ʵ�����ݿ�֪�¶�T1��T2
C.40minʱ��������M��Ӧ������Ϊ0.18
D.�÷�Ӧֻ���ڸ����²����Է�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2019��3�£��ҹ���ѧ���з���һ�����͵�п�ⵥҺ����أ���ԭ����ͼ��ʾ������˵������ȷ����

A. �ŵ�ʱB�缫��ӦʽΪ��I2+2e-=2I-
B. �ŵ�ʱ����ʴ�����������Ũ������
C. MΪ�����ӽ���Ĥ��NΪ�����ӽ���Ĥ
D. ���ʱ��A������65gʱ��C������������Ϊ4NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪C��D��G��IΪ������Ԫ���γɵĵ��ʣ�D��G��I������Ϊ��̬����GΪ����ɫ���γ�D��Ԫ��ԭ�ӵ������������Ǵ�����3����B����ɫ��Ӧ����ɫ(����ɫ�ܲ���)��KΪ����ɫ��ĩ����ת����ϵ��ͼ��

��ش�
��1����ҵ����C��A����H��ԭ�� ��
��2��д��C��K��Ӧ�Ļ�ѧ����ʽ ���÷�Ӧ�ķ�Ӧ�������� (��������������С����)��������������
��3��L��ĿǰӦ����㷺�Ľ�������̼����������L����������ͨ��Դ(��ʱ��)���Eˮ��Һ�Ļ�ѧ����ʽ ��
��4��д��E���ʵĵ���ʽ ��
��5��J��H��Ӧ�����ӷ���ʽΪ ��
��6��д��G����ʯ�ҷ�Ӧ��ȡƯ�۵Ļ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ե��ʳ��ˮΪ������ȡ�����Ȳ�Ʒ�Ĺ�ҵ��Ϊ���ȼҵ��������Ŀǰ��ѧ��ҵ����Ҫ֧��֮һ��
��1�������ʳ��ˮʱ����NaCl������Ϊ234 g���������������ɵ����������Ϊ________��(��״��)��
��2������2 mol������ͨ������ʯ�����У������Ͽɵõ��������________�ˡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧʵ��С���ͬѧΪ̽���ͱȽ�SO2����ˮ��Ư���ԣ��������ͼ��ʵ��װ�á�
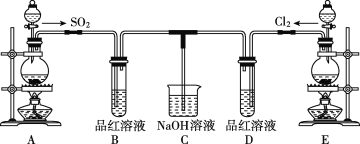
��1��ʵ������װ��E�Ʊ�Cl2���䷴Ӧ�Ļ�ѧ����ʽΪMnO2+4HCl(Ũ)![]() MnCl2+Cl2��+2H2O������6mol��HCl�μӷ�Ӧ����ת�Ƶĵ�������Ϊ____��
MnCl2+Cl2��+2H2O������6mol��HCl�μӷ�Ӧ����ת�Ƶĵ�������Ϊ____��
��2���ٷ�Ӧ��ʼһ��ʱ��۲쵽B��D�����Թ��е�Ʒ����Һ���ֵ������ǣ�B____��D____��
��ֹͣͨ�����ٸ�B��D�����Թֱܷ���ȣ������Թ��е�����ֱ�Ϊ��B____��D____��
��3����һ��ʵ��С���ͬѧ��ΪSO2����ˮ����Ư���ԣ�����Ϻ��Ư���Կ϶����ǿ�����ǽ��Ƶõ�SO2��Cl2��1��1ͬʱͨ�뵽Ʒ����Һ�У����������ɫЧ���������������������������������ԭ��(�û�ѧ����ʽ��ʾ)��____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijҺ̬±����RX(R�������X��ij��±ԭ��)���ܶ���a gcm��3��RX������ϡ���ˮ�ⷴӦ����ROH(�ܸ�ˮ����)��HX��Ϊ�˲ⶨRX����Է����������ⶨ��ʵ�鲽�����£�
��ȷ��ȡ��±����b mL��������ƿ�У�
������ƿ�м������ϡNaOH��Һ�����ϴ��г������ܵ����ӣ����ȣ�������Ӧ��
�۷�Ӧ��ɺ���ȴ��Һ����ϡ�����ữ���μӹ���AgNO3��Һ�õ���ɫ������
�ܽ��������ˡ�ϴ�ӡ��������أ��õ�����c g��
�ش��������⣺
(1)װ���г������ܵ�������____________________________��
(2)��±����������±�ص�������________���ж�������________________
(3)��RΪ�һ�����RX��KOH����Һ��Ӧ�ķ���ʽ________________
(4)����ڲ�����У���HNO3�������㣬û�н���Һ�ữ������ܲ�õ�cֵ________________
A��ƫ�� B��ƫС C������ D����С������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ҵβ��SO2��NO2����Ⱦ�������γ������������ס���ش��������⣺������(��ѧʽ��HNCO��CΪ+4��)����������β���е�NO2���䷴Ӧԭ��Ϊ��HNCO+NO2��N2+CO2+![]() (δ��ƽ)��
(δ��ƽ)��
��������Ӧ����������____________��
����ƽ����Ӧ��д____________��
��ÿ����33.6LNO2(��״��)����Ӧ��ת�Ƶ��ӵ���ĿΪ____________��
����Ϊ�˼���CO�Դ�������Ⱦ��ij�о���ѧϰС�����о�����CO��H2O��Ӧת��Ϊ��ɫ��ԴH2����֪��2CO��g��+O2��g���T2CO2��g����H=��566.0kJ mol��1��2H2��g��+O2��g���T2H2O��g����H=��483.6kJ mol��1��2H2O��g���TH2O��l����H=��44.0kJ mol��1��
��1��д��CO��H2O��g����������CO2��H2���Ȼ�ѧ����ʽ��____________��
��2�������Ǻϳɰ�����Ҫԭ�ϣ��ϳɰ���Ӧ���Ȼ�ѧ����ʽ���£�N2��g��+3H2��g��![]() 2NH3��g����H=��92.4kJmoL��1��
2NH3��g����H=��92.4kJmoL��1��
�ٵ��ϳɰ���Ӧ�ﵽƽ��ı�ijһ������������ı�N2��H2��NH3����������Ӧ������ʱ��Ĺ�ϵ��ͼ��ʾ��ͼ��t3ʱ����ƽ���ƶ�������������______�����б�ʾƽ��������NH3�ĺ�����ߵ�һ��ʱ����______��

���¶�ΪT��ʱ����1mol N2��2mol H2�����ݻ�Ϊ0.5L���ܱ������У���ַ�Ӧ����N2��ƽ��ת����Ϊ50%����Ӧ��T��ʱ��ƽ�ⳣ��Ϊ______mol��2L2��
��Ŀǰ��ҵ�ϳɰ���ԭ���ǣ�N2+3H2![]() 2NH3��ͼ��ʾ�������ı䣬ƽ����ϵ�а�����������ı仯���ƣ���������Ϊѹǿʱ���仯������ȷ���ǣ�����ţ���ͬ��___����������Ϊ�¶�ʱ���仯������ȷ����___��
2NH3��ͼ��ʾ�������ı䣬ƽ����ϵ�а�����������ı仯���ƣ���������Ϊѹǿʱ���仯������ȷ���ǣ�����ţ���ͬ��___����������Ϊ�¶�ʱ���仯������ȷ����___��

��3�������°�����HCl����������ˮ���ֽ���ͬ�������ͬ���ʵ���Ũ�ȵİ�ˮ�������ϣ�������Һ�и����ӵ����ʵ���Ũ�Ȱ����ɴ�С��˳����������Ϊ____��____��____��____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���绯ѧ���̵�ʾ��ͼ��ͼ��ʾ��

��ش��������⣺
(l)ͨ��CH3CH2OHһ���ĵ缫��ӦʽΪ__________________________��
(2)�ҳ���ͭ�ľ����أ���A�缫�IJ�����_____________����Ӧһ��ʱ����ҳ���Һ��c(Cu2��)__________(��������������С������������)��
(3)���غ���0.01 mol KCl����Һ100mL�������·��ת����0.03 mol e���������������������ڱ�״���µ������________��
(4)�����е��з�̪��ʵ�鿪ʼ��۲쵽��������_______________________________��д�����ص��ܷ�Ӧ����ʽ��________________________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com