
����Ŀ��ijҺ̬±����RX(R�������X��ij��±ԭ��)���ܶ���a gcm��3��RX������ϡ���ˮ�ⷴӦ����ROH(�ܸ�ˮ����)��HX��Ϊ�˲ⶨRX����Է����������ⶨ��ʵ�鲽�����£�
��ȷ��ȡ��±����b mL��������ƿ�У�
������ƿ�м������ϡNaOH��Һ�����ϴ��г������ܵ����ӣ����ȣ�������Ӧ��
�۷�Ӧ��ɺ���ȴ��Һ����ϡ�����ữ���μӹ���AgNO3��Һ�õ���ɫ������
�ܽ��������ˡ�ϴ�ӡ��������أ��õ�����c g��
�ش��������⣺
(1)װ���г������ܵ�������____________________________��
(2)��±����������±�ص�������________���ж�������________________
(3)��RΪ�һ�����RX��KOH����Һ��Ӧ�ķ���ʽ________________
(4)����ڲ�����У���HNO3�������㣬û�н���Һ�ữ������ܲ�õ�cֵ________________
A��ƫ�� B��ƫС C������ D����С������
���𰸡��������������ԭ�������� �� �μӹ���AgNO3��Һ���ð�ɫ���� CH3CH2Cl+KOH![]() CH2�TCH2��+KCl+H2O A
CH2�TCH2��+KCl+H2O A
��������
(1)װ���г������ܵ�����������������
(2)��±����������±�ص����ư�ˮ���к�Һ�м�������������ij�����ɫ�ش�
(3)��RΪ�һ�����RX��KOH����Һ������ȥ��Ӧ��
(4)����ڲ�����У���HNO3�������㣬û�н���Һ�ữ����ͨ�������ɷּ������жϡ�
(1) ��RX�۷е�ϵͣ�����ʱ�ӷ�������װ���г����ܵ������Ƿ�ֹ±�����ӷ�������������
��Ϊ���������������ԭ�������ʣ�
(2) ��Ϊ����AgX����Ϊ��ɫ���ܺ���������Ӧ���ɰ�ɫ������ֻ�����Ȼ�������������±�����к�����Ԫ�أ�
��Ϊ���ȣ��μӹ���AgNO3��Һ���ð�ɫ������
(3)��RΪ�һ�����RXΪCH3CH2Cl����KOH����Һ����ʱ������ȥ��Ӧ��CH3CH2Cl+KOH![]() CH2�TCH2��+KCl+H2O��
CH2�TCH2��+KCl+H2O��
����CH3CH2Cl+KOH![]() CH2�TCH2��+KCl+H2O��
CH2�TCH2��+KCl+H2O��
(4)����ڲ�����У���HNO3�������㣬û�н���Һ�ữ��������л���AgOHת��ΪAg2O����������������������������Ӱ�죬�ʲ�õ�cֵ��ƫ��ѡA��
����A��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й�����Ȼ���е�ѭ������ͼ����˵������ȷ���ǣ�
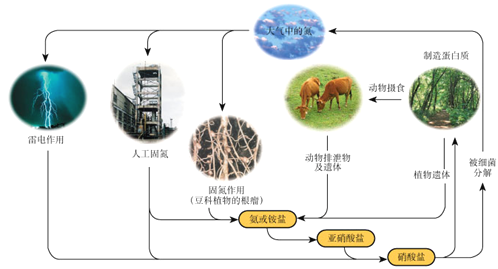
A. ��Ԫ�ؾ�������
B. ��ҵ�ϳɰ������˹��̵�
C. ��������ͺ����л�����ת��
D. ̼���⡢������Ԫ��Ҳ�����˵�ѭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�ij��Ԫ��X(OH)2ˮ��Һ�������ֵ����ʵ�����������ҺpH�仯��������ͼ��ʾ������˵����ȷ����

A. Kb2��������Ϊ10-5
B. X(OH)NO3ˮ��Һ������
C. �����ʵ�����X(NO3)2��X(OH)NO3�����Һ��c(X2+)>c[X(OH)+]
D. ��X(OH)NO3ˮ��Һ�У�c[X(OH)2]+c(OH-)=c(X2+)+c(H+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1���ϳɰ���ҵ���������õ���Fe��������Ҫ�ɷ���FeO��Fe2O3��
��ijFeO��Fe2O3������У���ԭ�ӡ���ԭ�ӵ����ʵ���֮��Ϊ4��5������FeO��Fe2O3�����ʵ���֮��Ϊ____��
�ڵ�������+2��Fe��+3��Fe�����ʵ���֮��Ϊ1��2ʱ�����������ߣ���ʱ����������Ļ��������ԭ�ӵ���������Ϊ____ (��С����ʾ������2λС��)��
��2�����ӹ�ҵ����30%��FeCl3��Һ��ʴ��Ե���ϵ�ͭ��������ӡˢ��·�塣
����FeOϡ���ᡢ������ȡFeCl3��Һ�����ӷ���ʽΪ____��____��������Һ��Fe3+���Լ���____��
��д��FeCl3��Һ�����ͭ������Ӧ�Ļ�ѧ����ʽ��____����ת�Ƶ�����Ϊ6.02��1024ʱ�������������ʵ�����Ϊ____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�����������7.0 mol/L������100 mL��һ��������ǡ����ȫ�ܽ⣬������Һ����ͨ��0.56L����µ�Cl2ʱ���պ�ʹ��Һ�е�Fe2+ȫ��ת��ΪFe3+�������������Fe2+��Fe3+�����ʵ���֮��Ϊ
A.1��4B.2��1C.4��1D.3��4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л�������������Ʒ�Ӧ�ų����������ȼ��8.88 g���л�������ȼ�պ������ͨ��Ũ������Ũ������������10.8 g����ʣ������ͨ��NaOH��Һ����Һ��������21.12 g���������Dz�ô����л������Է�������Ϊ74�����л�����Ũ����������·�����ȥ��Ӧʱ�����������л��������л�����ܵĽṹ��ʽΪ (����)
A. CH3CH2CH2CH2OH
B. CH3CH2CHOHCH3
C. (CH3)2CHCH2OH
D. (CH3)3COH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ��ʵ���ҳ�����ʱ���Ƶ�һ���Լ���ͼ����ʾ����ʵ����������ˮʱ��һ�ֳ���װ�ã�ͼ����ij��ѧʵ��С��������Ƶ�һ��������ˮ��װ��(ͼ�еĹ�������һ�־������嵥����������ƿ�й������������)(��֪������KMnO4������Ũ���ᷴӦ��������)��

��1����ˮ�к����������ӣ����еķ���Ϊ__(��ѧʽ)������ʱ���Ƶ�ԭ����__(�û�ѧ����ʽ��ʾ)��
��2��ͼ����ʾװ���У��ձ��ڵ�Һ����__���ձ��з�����Ӧ�Ļ�ѧ����ʽ��__��
��3����ͼ����ʾװ����������ˮʱ�������������£�
�ٹرջ���2����Һ©���ϿڵIJ��������ٴ���1��������Ũ����ע����Թ��ڡ�
�ڹرջ���1�����Ϸ�Һ©���Ͽڲ�������Ũ����ʹ��Թ��ڵĸ�����ط�ĩ��Ӧ����������
������ҡ��ƿA��ʹ������������ˮ�С�
��ͼ��װ�����ڽ϶�ʱ���ڵõ�������ˮ��������ҡ�������������������ˮ�ĽӴ������⣬��һ����Ҫԭ����__��
��Һ©���е�Ũ����Ӧ�����μ����Թ��ڡ���һ�μ���̫���Ũ���ᣬ��������ĺ����__��
��4��������ˮ��ɺ��ز�жװ�ü��ɴ�ƿA��ȡ��������ˮ��������__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����д�ʩ����ʵ��������������ԭ�����͵���
A.���Ƶ���ˮ�ڹ�������ɫ��dz
B.H2��I2��HIƽ��������ѹ����ɫ����
C.�ںϳɰ��ķ�Ӧ�У���ѹ�����ڰ��ĺϳ�
D.Fe��SCN��3��Һ�м���NaOH����Һ��ɫ��dz
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ��֤����Ȳ����������������Һ��Ӧ,ʵ�鷽������:����ʯ��ˮ��Ӧ���ɵ�����ͨ��������������Һ,��Һ��ɫ,֤�����߷����˷�Ӧ.��ش�:
��1���Ʊ���Ȳ�ķ�Ӧ�Ļ�ѧ����ʽ��______________��
��2����ͬѧ��ʵ�鷽�����ڵ�������______________��
��3��Ϊ�˽����������,������ѡ��ʵ��װ��,��ѡװ����ͼ��ʾ.

�ٽ�װ�ñ�Ű�˳�����ں�����_____��B��_____��
��Bװ������ʢ�ŵ��Լ���__________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com