
【题目】氯水是实验室常需临时配制的一种试剂。图甲所示的是实验室配制氯水时的一种常用装置,图乙是某化学实验小组自行设计的一种配制氯水的装置(图中的鼓气球是一种具有气体单向阀,可用于向瓶中鼓入空气的仪器)(已知常温下KMnO4固体与浓盐酸反应产生氯气)。

(1)氯水中含有七种粒子,其中的分子为__(化学式);需临时配制的原因是__(用化学方程式表示)。
(2)图甲所示装置中,烧杯内的液体是__,烧杯中发生反应的化学方程式是__。
(3)用图乙所示装置中配制氯水时,操作步骤如下:
①关闭活塞2,打开分液漏斗上口的玻璃塞,再打开活塞1,将少量浓盐酸注入大试管内。
②关闭活塞1,盖上分液漏斗上口玻璃塞。浓盐酸和大试管内的高锰酸钾粉末反应产生氯气。
③轻轻摇动瓶A,使氯气不断溶入水中。
用图乙装置能在较短时间内得到饱和氯水。除了在摇动过程中增大了气体和水的接触面以外,另一个重要原因是__。
分液漏斗中的浓盐酸应分数次加入试管内。若一次加入太多的浓盐酸,可能引起的后果是__。
(4)配制氯水完成后,不必拆卸装置即可从瓶A中取用少量氯水,方法是__。
【答案】Cl2、H2O、HClO 2HClO![]() 2HCl+O2↑ NaOH溶液 Cl2+2NaOH=NaCl+NaClO+H2O 氯气在瓶内产生较大压强,增大了氯气的溶解度 瓶内产生过多的氯气,瓶内压强过大会使瓶A的橡胶塞弹开 打开活塞2,关闭活塞1,用鼓气球向瓶A中鼓入空气
2HCl+O2↑ NaOH溶液 Cl2+2NaOH=NaCl+NaClO+H2O 氯气在瓶内产生较大压强,增大了氯气的溶解度 瓶内产生过多的氯气,瓶内压强过大会使瓶A的橡胶塞弹开 打开活塞2,关闭活塞1,用鼓气球向瓶A中鼓入空气
【解析】
⑴氯水中含有七种粒子为三分子、四离子,由于次氯酸见光或受热分解,需临时配制。
⑵图甲所示装置中,左边是制备氯水,右边是处理尾气。
⑶瓶A内压强增大,可以增大了氯气在水中的溶解度,分液漏斗中的浓盐酸应分数次加入试管内,避免一次加入太多的浓盐酸,产生大量的氯气,瓶A中压强过大,容易将瓶A的活塞弹开。
⑷配制氯水完成后,不必拆卸装置即可从瓶A中取用少量氯水,打开活塞2,将瓶A中的压强增大,液体压出。
⑴氯水中含有七种粒子为Cl2、H2O、HClO、Cl-、H+、ClO-、OH-,其中的分子为Cl2、H2O、HClO (化学式);由于次氯酸见光或受热分解,需临时配制的原因是2HClO![]() 2HCl+O2↑;故答案为:Cl2、H2O、HClO;2HClO
2HCl+O2↑;故答案为:Cl2、H2O、HClO;2HClO![]() 2HCl+O2↑。
2HCl+O2↑。
⑵图甲所示装置中,左边是制备氯水,右边是处理尾气,因此烧杯内的液体是NaOH溶液,烧杯中发生反应的化学方程式是Cl2+2NaOH=NaCl+NaClO+H2O;故答案为:NaOH溶液;Cl2+2NaOH=NaCl+NaClO+H2O。
⑶另一个重要原因是生成的氯气在瓶A中,压强增大,增大了氯气在水中的溶解度;分液漏斗中的浓盐酸应分数次加入试管内,若一次加入太多的浓盐酸,产生大量的氯气,瓶A中压强过大,容易将瓶A的活塞弹开;故答案为:氯气在瓶内产生较大压强,增大了氯气的溶解度;瓶内产生过多的氯气,瓶内压强过大会使瓶A的橡胶塞弹开。
⑷配制氯水完成后,不必拆卸装置即可从瓶A中取用少量氯水,打开活塞2,将瓶A中的压强增大,液体压出,故答案为:打开活塞2,关闭活塞1,用鼓气球向瓶A中鼓入空气。


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案科目:高中化学 来源: 题型:
【题目】将盛有25mLNO2和O2混合气体的量筒倒置于水槽中,一段时间后,气体体积减小到5mL且不再变化(同温同压下)。则原混合气体中NO2和O2的体积比可能是( )
A.1:1B.18:7C.16:9D.23:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以电解食盐水为基础制取氯气等产品的工业称为“氯碱工业”,它是目前化学工业的重要支柱之一。
(1)若电解食盐水时消耗NaCl的质量为234 g,则在理论上最多可得氯气的体积为________升(标准状况)。
(2)若将2 mol的氯气通入足量石灰乳中,理论上可得到次氯酸钙________克。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某液态卤代烷RX(R是烷基,X是某种卤原子)的密度是a gcm﹣3.RX可以与稀碱发生水解反应生成ROH(能跟水互溶)和HX.为了测定RX的相对分子质量,拟定的实验步骤如下:
①准确量取该卤代烷b mL,放入锥形瓶中.
②在锥形瓶中加入过量稀NaOH溶液,塞上带有长玻璃管的塞子,加热,发生反应.
③反应完成后,冷却溶液,加稀硝酸酸化,滴加过量AgNO3溶液得到白色沉淀.
④将沉淀过滤、洗涤、干燥后称重,得到固体c g.
回答下列问题:
(1)装置中长玻璃管的作用是____________________________.
(2)该卤代烷中所含卤素的名称是________,判断依据是________________
(3)如R为乙基,则RX与KOH醇溶液反应的方程式________________
(4)如果在步骤③中,加HNO3的量不足,没有将溶液酸化,则步骤④测得的c值________________
A.偏大 B.偏小 C.不变 D.大小不定.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ZrO2是重要的耐温材料,可用作陶瓷遮光剂。天然锆英石(ZrSiO4)含有铁、铝、铜等金属元素的氧化物杂质,工业以锆英石为原料制备ZrO2的工艺流程如下: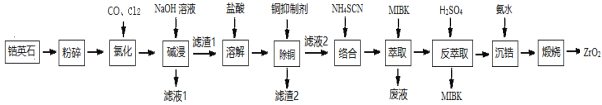
已知:①锆英石中锆元素的化合价为+4 ,“氯化”过程中除C、O元素外,其他元素均转化为最高价氯化物 ②SiCl4极易水解;ZrCl4易溶于水 ③Fe(SCN)3难溶于有机溶剂MIBK; Zr(SCN)4在水中溶解度不大,易溶于有机溶剂MIBK。
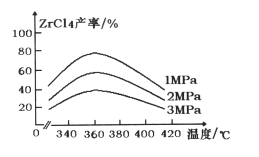
(1) “氯化”过程中,锆英石发生的主要反应的化学方程式为:______________________________,ZrC14的产率随温度变化如图所示,由图可知氯化的最佳条件是_____________;
(2)“滤液1”中含有的阴离子除OH- 、Cl-,还有___________________;
(3)常用的铜抑制剂有Na2S、H2S、NaCN等,本流程使用NaCN除铜,不采用Na2S、H2S的原因是__________。
(4)实验室进行萃取和反萃取的玻璃仪器是_______。流程中萃取与反萃取的目的是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(Ⅰ)工业尾气SO2、NO2是污染大气、形成酸雨的罪魁祸首。请回答下列问题:异氰酸(化学式:HNCO,C为+4价)可用于消除尾气中的NO2。其反应原理为:HNCO+NO2→N2+CO2+![]() (未配平)。
(未配平)。
①上述反应的氧化剂是____________。
②配平后方框内应填写____________。
③每处理33.6LNO2(标准状况),反应中转移电子的数目为____________。
(Ⅱ)为了减少CO对大气的污染,某研究性学习小组拟研究利用CO和H2O反应转化为绿色能源H2.已知:2CO(g)+O2(g)═2CO2(g)△H=﹣566.0kJ mol﹣1;2H2(g)+O2(g)═2H2O(g)△H=﹣483.6kJ mol﹣1;2H2O(g)═H2O(l)△H=﹣44.0kJ mol﹣1。
(1)写出CO和H2O(g)作用生成CO2和H2的热化学方程式:____________。
(2)氢气是合成氨的重要原料,合成氨反应的热化学方程式如下:N2(g)+3H2(g)![]() 2NH3(g)△H=﹣92.4kJmoL﹣1。
2NH3(g)△H=﹣92.4kJmoL﹣1。
①当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如图所示.图中t3时引起平衡移动的条件可能是______,其中表示平衡混合物中NH3的含量最高的一段时间是______。

②温度为T℃时,将1mol N2和2mol H2放入容积为0.5L的密闭容器中,充分反应后测得N2的平衡转化率为50%.则反应在T℃时的平衡常数为______mol﹣2L2。
③目前工业合成氨的原理是:N2+3H2![]() 2NH3如图表示随条件改变,平衡体系中氨气体积分数的变化趋势,当横坐标为压强时,变化趋势正确的是(填序号,下同)___,当横坐标为温度时,变化趋势正确的是___。
2NH3如图表示随条件改变,平衡体系中氨气体积分数的变化趋势,当横坐标为压强时,变化趋势正确的是(填序号,下同)___,当横坐标为温度时,变化趋势正确的是___。

(3)常温下氨气和HCl均极易溶于水,现将相同体积、相同物质的量浓度的氨水和盐酸混合,所得溶液中各离子的物质的量浓度按照由大到小的顺序排列依次为____>____>____>____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醛在催化剂存在的条件下,可以被空气氧化成乙酸。依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体)。已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全。有关物质的沸点见下表:
物质 | 乙醛 | 乙酸 | 甘油 | 乙二醇 | 水 |
沸点 | 20.8℃ | 117.9℃ | 290℃ | 197.2℃ | 100℃ |
请回答下列问题:
(1)试管A内在60℃~80℃时发生的主要反应的化学方程式为(注明反应条件)________________;
(2)如图所示在实验的不同阶段,需要调整温度计在试管A内的位置。在实验开始时温度计水银球的位置应在___________,目的是_____________________________;当试管A内的主要反应完成后,应进行蒸馏操作,温度计水银球的位置应在___________________。

(3)烧杯B内盛装的液体可以是____________(写出一种即可)。
(4)若想检验试管C中是否含有产物乙酸,在下列所提供的药品或用品中,可以使用的是____________。(填字母)
a.pH试纸 b.碳酸氢钠粉末
c.红色石蕊试纸 d.银氨溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、W均为中学常见的纯净物,它们之间有如下转化关系(其他产物及反应条件已略去,反应可以在水溶液中进行):![]() 。三种物质的焰色反应均为黄色;C常作面包和糕点的发泡剂,受热分解可生成B。
。三种物质的焰色反应均为黄色;C常作面包和糕点的发泡剂,受热分解可生成B。
(1)写出下列物质的化学式A______,B________,C________,W________。
(2)写出A溶液与C溶液反应的离子方程式为_______________________________。
(3)向两份30 mL同浓度的A溶液中通入不同体积的W气体,得到溶液M、N。向M、N溶液中逐滴加入浓度为0.25 mol·L-1盐酸,如图所示Ⅰ和Ⅱ分别为加入V(盐酸)与产生V(W)的关系。通过计算确定A溶液的物质的量浓度为 _______________。

(4)M、N两溶液中相同溶质的物质的量之比为多少_______?(写出必要的文字说明和计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的分类如图所示:

由图判断下列说法中不正确的是( )
A.甲图所示的分类方法属于树状分类法
B.乙图所示的分类方法属于交叉分类法
C.碱性氧化物一定是金属氧化物
D.非金属氧化物一 定是酸性氧化物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com