
【题目】将盛有25mLNO2和O2混合气体的量筒倒置于水槽中,一段时间后,气体体积减小到5mL且不再变化(同温同压下)。则原混合气体中NO2和O2的体积比可能是( )
A.1:1B.18:7C.16:9D.23:2
科目:高中化学 来源: 题型:
【题目】常见元素A、B、M组成的四种物质发生反应:甲+乙=丙+丁,其中甲由A和M组成,乙由B和M组成,丙中只含有M。
(1)若甲为淡黄色固体,乙和丙均为常温下的无色无味气体。则甲中含有的化学键类型是___;常温下丁溶液显___性(填“酸”或“碱”或“中”),原因是____(用离子方程式表示);
(2)若丁为能使品红褪色的无色气体,丁与水反应生成戊,丙为常见红色金属,化合物甲、乙中原子个数比均为1∶2(M均显+1价),原子序数B大于A。回答下列问题:
①写出加热条件下上述生成丙的化学方程式____;
②已知常温下弱电解质的电离平衡常数如下:一水合氨![]() ,戊:
,戊:![]() ,
,![]() 。若一水合氨与丁恰好完全反应生成酸式盐,则浓度为
。若一水合氨与丁恰好完全反应生成酸式盐,则浓度为![]() 的该盐溶液pH___7(填“>”“<”或“=”);调整二者反应的比值可使溶液呈中性,此时溶液中
的该盐溶液pH___7(填“>”“<”或“=”);调整二者反应的比值可使溶液呈中性,此时溶液中![]() ____
____![]() (同上)。
(同上)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用氧化还原反应原理配平
(1)__NH3+___O2![]() ____NO +____H2O
____NO +____H2O
(2)____FeSO4+____KNO3+____H2SO4=____K2SO4+____Fe2(SO4)3+____NO↑+____H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于自然界中氮循环(如图)的说法不正确的是:
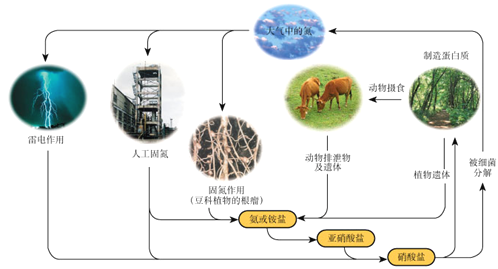
A. 氮元素均被氧化
B. 工业合成氨属于人工固氮
C. 含氮无机物和含氮有机物可相互转化
D. 碳、氢、氧三种元素也参与了氮循环
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业水合碱碳酸镁简称轻质碳酸镁【3MgCO3.Mg(OH)2.3H2O】,相对密度小,质轻而松,广泛用于橡胶制品、防火保湿材料和日货用品中等。一种以富含氯化镁。硫酸镁的卤水和白云石【CaMg(CO3)2】为原料的卤水碳化法生产轻质碳酸镁的工艺流程如下:
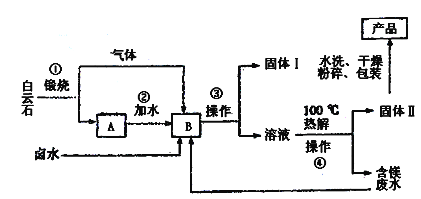
已知:MgCO3比CaCO3更易与CO2反应生成可溶性盐。
(1)为了使第①步白云石煅烧得更充分,常常要对矿石进行__预处理。
(2)第③步和第④步操作的名称是__,在实验室进行该操作时需要的玻璃仪器有
__。
(3)固体I的主要成分为____,固体II的主要成分为____。水洗固体II时,如何判断已经洗净,请简述其过程:____。
(4)写出第④步反应的化学方程式:____。
(5)该流程中能同体现提高效益、减少废物排放思想的两项设计是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸晶体的组成可表示为H2C2O4xH2O,通过下列实验测定x值,步骤如下:
①称取6.30 g草酸晶体配成100 mL水溶液。
②取25.00mL所配草酸溶液置于锥形瓶中,加入适量稀硫酸,用0.5000molL-1KMnO4溶液进行滴定,到达滴定终点时,消耗KMnO4溶液10.02mL。
③重复②步骤2次,消耗KMnO4溶液的体积分别为11.02mL和9.98mL。已知:H2C2O4 +MnO4- +H+ → CO2 ↑+Mn2++H2O (方程式未配平)
(1)步骤①配制草酸溶液时,需用的玻璃仪器:烧杯、玻璃棒和______;
(2)判断到达滴定终点的实验现象是______;
(3)其它操作正确的情况下,以下操作会使测定的x值偏小的是______;
A 滴定管水洗后未用KMnO4溶液润洗
B 锥形瓶用蒸馏水洗净之后,用草酸溶液润洗
C 开始滴定时滴定管尖嘴处有气泡,滴定结束气泡消失
D 滴定终点读数时,俯视滴定管的刻度
(4)根据以上实验数据计算x值 ______。 (写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 1molNa2O2与SO2完全反应,转移2NA个电子
B. 标准状况下,11.2L乙醇中含有的极性共价键数目为3.5NA
C. 18g的D2O中含有的中子数为10NA
D. 1L0.1mol·L-1Fe2(SO4)3溶液中含有的阳离子数目小于0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,某二元碱X(OH)2水溶液中相关组分的物质的量分数随溶液pH变化的曲线如图所示,下列说法正确的是

A. Kb2的数量级为10-5
B. X(OH)NO3水溶液显酸性
C. 等物质的量的X(NO3)2和X(OH)NO3混合溶液中c(X2+)>c[X(OH)+]
D. 在X(OH)NO3水溶液中,c[X(OH)2]+c(OH-)=c(X2+)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯水是实验室常需临时配制的一种试剂。图甲所示的是实验室配制氯水时的一种常用装置,图乙是某化学实验小组自行设计的一种配制氯水的装置(图中的鼓气球是一种具有气体单向阀,可用于向瓶中鼓入空气的仪器)(已知常温下KMnO4固体与浓盐酸反应产生氯气)。

(1)氯水中含有七种粒子,其中的分子为__(化学式);需临时配制的原因是__(用化学方程式表示)。
(2)图甲所示装置中,烧杯内的液体是__,烧杯中发生反应的化学方程式是__。
(3)用图乙所示装置中配制氯水时,操作步骤如下:
①关闭活塞2,打开分液漏斗上口的玻璃塞,再打开活塞1,将少量浓盐酸注入大试管内。
②关闭活塞1,盖上分液漏斗上口玻璃塞。浓盐酸和大试管内的高锰酸钾粉末反应产生氯气。
③轻轻摇动瓶A,使氯气不断溶入水中。
用图乙装置能在较短时间内得到饱和氯水。除了在摇动过程中增大了气体和水的接触面以外,另一个重要原因是__。
分液漏斗中的浓盐酸应分数次加入试管内。若一次加入太多的浓盐酸,可能引起的后果是__。
(4)配制氯水完成后,不必拆卸装置即可从瓶A中取用少量氯水,方法是__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com