
黄铁矿是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对某黄铁矿石(主要 成分为FeS2)进行硫元素含量测定的实验探究及工业生产硫酸的探究。
I .将m1,g该黄铁矿样品(杂质中不含硫和铁)放入如下图所示装置(夹持和加热装置 省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:4FeS2 + 11O2 2Fe2O3 + 8SO2
2Fe2O3 + 8SO2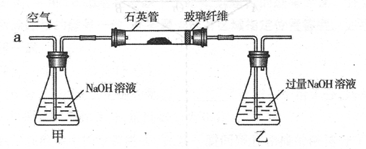
II反应结束后,将乙瓶中的溶液进行如下处理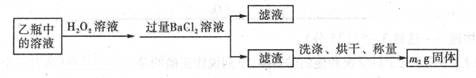
(1)I中,乙瓶内发生反应的离子方程式有____________、__________。
(2)II中,所加H2O2溶液需足量的理由是____________________________
(3)该黄铁矿石中硫元素的质量分数为____________________________
(4)简述在催化反应室中设置热交换器的目的:______________。
(5)工业生产中常用氨——硫酸法进行尾气脱硫,以达到消除污染、废物利用的目的,用 两个化学方程式表示其反应原理_______________、______________
(15分)
(1)SO2 + 2OH-=SO32- + H2O (2分)2SO32-+ O2= 2SO42-(2分)
(2)使SO32-完全氧化为SO42- (2分)(3)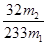 ×100%
×100%
(4)利用SO2氧化为SO3时放出的热量来预热即将参加反应的SO2和O2等(2分)
SO2+2NH3?H2O═(NH4)2SO3,(NH4)2SO3+H2SO4═(NH4)2SO4+SO2↑+H2O.(2分)
解析试题分析:(1)乙中二氧化硫和氢氧化钠反应生成亚硫酸钠,离子方程式为 SO2+2OH-=SO32-+H2O,亚硫酸钠和氧气反应生成硫酸钠,离子方程式为2SO32-+O2=2SO42-,故答案为: SO2+2OH-=SO32-+H2O;2SO32-+O2=2SO42-;(2)为使亚硫酸根离子完全转化为硫酸根离子,加入的双氧水要足量,故答案为:使SO32-完全氧化为SO42-;(3)最终所得沉淀是硫酸钡,根据硫原子守恒得硫的质量,设硫的质量为x,
S-----BaSO4
32g 233g
x m2g
x=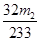 g 质量分数=
g 质量分数=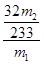 ×100%=
×100%=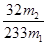 ×100%
×100%
(4)在S02催化氧化设备中设置热交换器,把不同温度之间的气体进行热交换,可预热反应气体,冷却生成气体,可起到充分利用能源的目的,(5)工业生产中常用氨-酸法进行尾气脱硫,即先用氨水吸收,再用浓硫酸处理.先用氨水吸收时,发生反应:SO2+2NH3?H2O═(NH4)2SO3,再用浓硫酸处理时,发生反应:(NH4)2SO3+H2SO4═(NH4)2SO4+SO2↑+H2O,以达到消除污染、废物利用的目的.
故答案为:SO2+2NH3?H2O═(NH4)2SO3,(NH4)2SO3+H2SO4═(NH4)2SO4+SO2↑+H2O.
考点:探究物质的组成或测量物质的含量;含硫物质的性质及综合应用


 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:实验题
某兴趣小组设计如下图实验装置进行实验。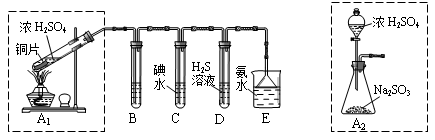
Ⅰ、探究大气污染物SO2的性质
(1)为了实现绿色环保的目标,能否用上图A2代替A1装置 (填“能”或“否”)。
(2)B、C、D分别用于检验SO2的漂白性、还原性和氧化性,则B中所盛试剂
为 ,C中反应的离子方程式为 ,D中反应的化学方程式
为 。
Ⅱ、探究铜片与浓H2SO4反应的产物
实验结束,发现在铜片表面附着黑色固体。查阅资料得知:此黑色固体可
能含有CuO、CuS、Cu2S。常温下CuS和Cu2S都不溶于稀盐酸,在空气中煅烧都转化为Cu2O和SO2。该小组同学收集一定量黑色固体,按如下实验方案探究其成分: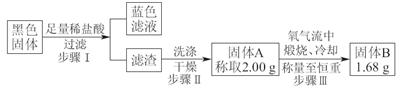
(3)步骤Ⅱ 中检验滤渣洗涤干净的实验方法是____________________________。
(4)黑色固体的成分是________________。
Ⅲ、尾气处理
用氨水吸收尾气中的SO2,“吸收液”中可能含有OH-、SO32-、SO42-、HSO3-等阴离子。
(5)氨水吸收过量SO2的反应的离子方程为 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
为了证实木炭和浓H2SO4的反应产物,可用下列流程进行验证(箭头表示气体的流向)。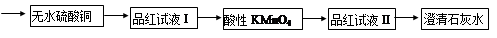
回答下列问题:
根据上述流程中什么现象证明产物是H2O、CO2、SO2:
; ; 。
(2)酸性KMnO4溶液的作用是 ,能否用溴水代替酸性高锰酸钾溶液? 。(填“能”或“不能”),请写出化学反应方程式 (若回答不能,则此空不用答题)
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某同学在学习硝酸与硫酸时,对两种酸与铜的反应情况进行研究,试完成下列各题。
(1)在甲、乙两个烧杯中,分别装入40mL浓度均为2mol·L-1的稀硫酸和稀硝酸,并向其中各加入 4g束状铜丝,观察现象,试完成下列实验报告: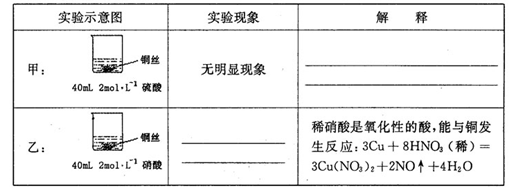
(2)充分反应后,将甲、乙烧杯混合,再使之充分反应,最终所得溶液溶质为____ ,剩余固体总质量为 g
(3)若甲中硫酸溶液体积V(V>40mL)可变,其余数据不变,则:
①当甲、乙烧杯混合充分反应后,溶液中只有一种溶质时,V=____ mL,若要将溶液中的Cu2+沉淀完全,应加NaOH使溶液的pH至少为____ 。已知KsP[Cu(OH)2]=2.2×l0-20,1g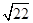 =0.7)
=0.7)
②能否通过硫酸溶液体积的改变,使铜丝在甲、乙烧杯混合充分反应后完全溶解? 试写出推理过程________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某化学兴趣小组的同学利用下图所示实验装置进行实验(图中a、b、c表示止水夹)。
|
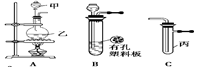
 请按要求填空:
请按要求填空:| 实验序号 | 实验操作 | 现象 | 结论 |
| Ⅰ | 将氯水滴入品红溶液 | 溶液褪色 | 氯气与水反应的产物有漂白性 |
| Ⅱ | 氯水中加入 NaHCO3粉末 | 有无色气泡产生 | 氯气与水反应的产物具有较强的酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。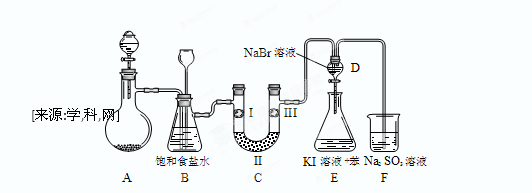
(1)制备氯气选用的药品为:漂粉精固体【主要成分为Ca(ClO)2】和浓盐酸,相关的化学反应方程式为: 。
(2)装置B中饱和食盐水的作用是 ;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象 。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入 。
| | a | b | c | d |
| I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| II | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| III | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
氯化铜是一种广泛用于生产颜料、木材防腐剂等的化工产品。某研究小组用粗铜(含杂质Fe)按下述流程制备氯化铜晶体(CuCl2·xH2O)。
(1)实验室采用如图所示装置,可使粗铜与Cl2反应转化为固体1(部分加热仪器和夹持装置已略去)。该装置中仪器a的名称是 。装置b中发生反应的离子方程式是 。该装置存在一定的安全隐患,消除该安全隐患的措施是 。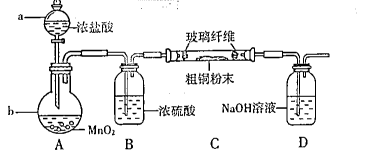
(2)操作Ⅱ中应控制的pH范围为 ,其目的是 。
已知: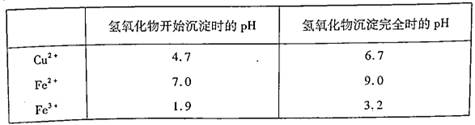
(3)操作Ⅲ的程序依次为 、 、过滤、自然干燥.得到CuCl2·xH2O晶体。
(4)若制备的氯化铜晶体经检验含有FcCl2,其原因可能是 ,试提出两种不同的改进方案:① ;② 。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
(15分)下图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I是第三周期原子半径最小的金属元素组成的单质,D是一种红棕色固体粉末,G为单质,K是一种红棕色气体,A、B相对分子质量相差16,J、C都是常见的强酸。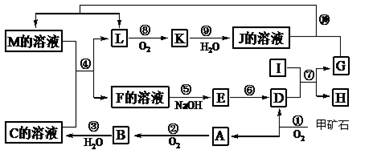
请填写下列空白:
(1)写出下列物质的化学式B E 。
(2)反应⑦的化学方程式为 。反应⑦属于 。
A.吸热反应 B.放热反应 C.置换反应 D.氧化还原反应
(3)反应⑩的离子方程式为 。
(4)将化合物D与KNO3、KOH混合,在高温条件下可制得一种“绿色”环保高效净水剂K2GO4(G显+6价),同时还生成KNO2和H2O。该反应的化学方程式是: 。
(5)反应①中生成的A、D物质的量之比为4:1,已知甲矿石的主要成分是由两种元素组成的化合物,则该化合物的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知A、B为单质,C为化合物。
①若C溶于水后得到强碱溶液,则A可能是Na
②若C溶液遇Na2CO3,放出CO2气体,则A可能是H2
③若C溶液中滴加过量NaOH溶液,先出现浑浊后澄清,则B可能为Al
④若C溶液中滴加NaOH溶液有蓝色沉淀生成,则B可能为Cu
能实现上述转化关系的是( )
A.②④ B.①② C.②③④ D.③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com