
【题目】滴定分析是一种常用的定量分析法。请回答下列问题:
Ⅰ.某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。
(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视_________________________,直到因加入一滴盐酸后,溶液由黄色突变为橙色,并半分钟内不恢复为止。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是_________(填字母序号)。
a.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
b.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
c.酸式滴定管在滴定前有气泡,滴定后气泡消失
d.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
Ⅱ.25℃时,向20mL 0.1 mol·L-1的HA溶液中逐滴加入0.1 mol·L-1NaOH溶液,滴加过程中混合溶液的pH变化曲线如图所示。

(3)①滴加NaOH溶液至恰好反应的过程中,水的电离程度_____________(填写“逐渐增大”、“不变”或“逐渐减小”);
②若以NaOH溶液为标准液,通过滴定的方法测定另一未知浓度的HA溶液的浓度,推测最好使用的指示剂为___________________________(常见指示剂的变色范围是:甲基橙3.1~4.4,酚酞8~10)。
③b点时,共滴入0.1 mol·L-1NaOH溶液体积为V mL,用含V的代数式表示HA的电离平衡常数Ka=__;
Ⅲ.KMnO4溶液常用作氧化还原反应滴定的标准液,四氯化硅粗产品经精馏后,得到的残留物中常含有铁元素,为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:5Fe2++![]() +8H+=5Fe3++Mn2++4H2O
+8H+=5Fe3++Mn2++4H2O
(4)①滴定前是否要滴加指示剂?_____________ (填“是”或“否”),请说明理由:_____________________________________________;
②某同学称取10.000 g 残留物,经预处理后在容量瓶中配制成100 mL溶液,移取25.00 mL试样溶液,用 1.000×10-2 mol·L-1 KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00 mL,则残留物中铁元素的质量分数是______________________。
【答案】锥形瓶内溶液的颜色变化 d 增大 酚酞 ![]() 否 MnO4-转变成Mn2+溶液颜色由紫色变成无色 2.240%
否 MnO4-转变成Mn2+溶液颜色由紫色变成无色 2.240%
【解析】
Ⅰ.(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶内溶液的颜色变化,直到因加入一滴盐酸后,溶液由黄色突变为橙色,并半分钟内不恢复为止。
(2)a.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸,标准液的浓度偏小,造成V(标准)偏大,根据c(待测)=![]() 可知,测定c(NaOH)偏大,故a错误;
可知,测定c(NaOH)偏大,故a错误;
b.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥,待测液的物质的量不变,对V(标准)无影响,根据c(待测)=![]() 可知,测定c(NaOH)无影响,故b错误;
可知,测定c(NaOH)无影响,故b错误;
c.酸式滴定管在滴定前有气泡,滴定后气泡消失,造成V(标准)偏大,根据c(待测)=可知,测定c(NaOH)偏大,故c错误;
d.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数,造成V(标准)偏小,根据c(待测)=![]() 可知,测定c(NaOH)偏低,故d正确;
可知,测定c(NaOH)偏低,故d正确;
故选d;
Ⅱ.(3)①酸抑制水的电离,氢离子浓度减小,则水的电离程度增大,滴加NaOH溶液至恰好反应的过程中,消耗氢离子,则氢离子浓度减小,所以水的电离程度逐渐增大;
②若以NaOH溶液为标准液,通过滴定的方法测定另一未知浓度的HA溶液的浓度,由图生成物NaA溶液呈碱性,推测最好使用的指示剂为酚酞;
③NaA为强碱弱酸盐,其溶液呈碱性,要使溶液呈中性,则酸应该稍微过量,呈中性时,溶液中c(Na+)=c(A-)=![]() mol·L-1,c(HA)=
mol·L-1,c(HA)=![]() ,电离平衡常数Ka=
,电离平衡常数Ka= =
=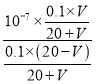 =
=![]() ;
;
Ⅲ.(4)①MnO4-转变成Mn2+溶液颜色由紫色变成无色,KMnO4标准溶液在酸性条件下进行氧化还原滴定时,不需要指示剂;
②用关系式法计算:即5Fe2+~MnO4-,铁元素的质量为:5×1.000×10-2mol·L-1×0.02L×4×56g·mol-1=2.24×10-1g,铁元素的质量分数![]() ×100%=2.240%。
×100%=2.240%。


科目:高中化学 来源: 题型:
【题目】已知反应:FeO(s)+CO(g) = Fe(s)+CO2(g) 的Kc=0.5(1273K)。若起始浓度c(CO)=0.05 mol/L,c(CO2)=0.01 mol·L-1,请回答:
(1)判断化学反应进行的方向并计算反应物、生成物的平衡浓度。
(2)CO的转化率是多少?
(3)增加FeO的量,对平衡有无影响?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸![]() 溶液与酸性
溶液与酸性![]() 溶液反应时,溶液褪色总是先慢后快,某学习小组探究反应过程中使褪色加快的主要原因,过程如下:
溶液反应时,溶液褪色总是先慢后快,某学习小组探究反应过程中使褪色加快的主要原因,过程如下:
(查阅资料)![]() 溶液氧化
溶液氧化![]() 的反应历程为:
的反应历程为:
![]()
(提出假设)假设1:该反应为放热
假设2:反应生成的Mn2+对该反应有催化作用
假设3:K+对该反应有催化作用
该小组同学未提出浓度使反应速率加快的假设,原因是______。
(设计、完成实验)
![]() 称取______g草酸晶体
称取______g草酸晶体![]() ,配置500mL
,配置500mL![]()
![]() 溶液。
溶液。
①在上述过程中必须用到的2种定量仪器是托盘天平和______。
②下列操作会使所配溶液浓度偏低的是______![]() 填下列选项的字母序号
填下列选项的字母序号![]() 。
。
A 称取草酸晶体时,将草酸晶体放在托盘天平右盘
B 定容时俯视刻度线
C 将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水
D 摇匀后,发现溶液液面低于刻度线,立即用胶头滴管加水再定容
![]() 完成探究,记录数据
完成探究,记录数据
实验 编号 | 烧杯中所加试剂及用量 | 控制条件 | 溶液褪 色时间
| |||
| 等浓度
|
|
稀硫酸 | |||
1 | 30 | 20 | 30 | 20 | 18 | |
2 | 30 | 20 | 30 | 20 | 水浴控制温度 | 15 |
3 | 30 | 20 | 30 | 20 | 加入少量 |
|
4 | 30 | 20 | x | 20 | 加入5mL
| 18 |
则![]() ______,假设______成立。
______,假设______成立。
![]() 由于
由于![]() 能氧化水中有机物等因素,配置好稳定的
能氧化水中有机物等因素,配置好稳定的 溶液,其浓度需标定.取
溶液,其浓度需标定.取![]()
![]()
![]() 溶液于锥形瓶中,加入10mL
溶液于锥形瓶中,加入10mL![]() 稀硫酸,用
稀硫酸,用![]() 中
中![]() 溶液滴定至锥形瓶中恰好呈浅紫色,且半分钟不褪色,记录数据,平行三次实验,平均消耗
溶液滴定至锥形瓶中恰好呈浅紫色,且半分钟不褪色,记录数据,平行三次实验,平均消耗![]() 溶液
溶液![]() ,则草酸溶液与酸性
,则草酸溶液与酸性![]() 溶液反应的离子方程式为:______,上述实验中
溶液反应的离子方程式为:______,上述实验中![]() 溶液的物质的量浓度为______。
溶液的物质的量浓度为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现使用酸碱中和滴定法测定市售白醋![]() 主要成分是
主要成分是![]() 的总酸量
的总酸量![]() 。已知
。已知![]() 终点时所得溶液呈碱性。
终点时所得溶液呈碱性。
Ⅰ、实验步骤:
(1)用移液管量取![]() 食用白醋,在烧杯中用水稀释后转移到100mL容量瓶中定容,摇匀即得待测白醋溶液。
食用白醋,在烧杯中用水稀释后转移到100mL容量瓶中定容,摇匀即得待测白醋溶液。
(2)用酸式滴定管取待测白醋溶液![]() 于锥形瓶中。
于锥形瓶中。
(3)滴加2滴_____________作指示剂。
(4)读取盛装![]() 溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为 ________mL。
溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为 ________mL。

(5)滴定,当______________________时,停止滴定,并记录NaOH溶液的终读数。重复滴定3次。Ⅱ![]() 实验记录
实验记录

Ⅲ、数据处理与讨论:
(1)根据上述数据分析得![]() 市售白醋
市售白醋![]() ________
________![]() 。
。
(2)在本实验的滴定过程中,下列操作会使实验结果偏小的是_______![]() 填写序号
填写序号![]() 。
。
A.碱式滴定管在滴定时未用标准NaOH溶液润洗
B.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
C.锥形瓶中加入待测白醋溶液后,再加少量水
D.锥形瓶在滴定时剧烈摇动,有少量液体溅出
E. 滴定终点读数时俯视
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大力发展电动汽车,可以有效控制空气污染。目前机动车常使用的电池有铅蓄电池、锂电池等。
I.铅蓄电池充放电的总反应为:PbO2+Pb+2H2SO4![]() 2PbSO4+2H2O。锂硫电池充放电的总反应为:2Li+S
2PbSO4+2H2O。锂硫电池充放电的总反应为:2Li+S![]() Li2S。
Li2S。
(1)铅蓄电池的负极材料为________________________。
(2)当消耗等质量的负极活性物质时,锂硫电池的理论放电量是铅蓄电池的___________倍。(保留三位有效数字)
II.由方铅矿(PbS)制备铅蓄电池电极材料(PbO2)的方法如下:

(3)步骤①酸溶时,为提高酸溶速率,可采取的措施是____________ (任写一条)。
(4)已知 25℃时,Ksp(PbSO4)=1.82×10-8,Ksp(PbCO3)=1.46×10-13。若步骤②沉铅后的滤液中c(Pb2+)=1.82×10-6 mol·L-1,则此时c(![]() )=_____________ mol·L-1。
)=_____________ mol·L-1。
(5)步骤③向PbSO4中加Na2CO3溶液会发生:PbSO4(s)+![]() (aq)=PbCO3(s)+
(aq)=PbCO3(s)+![]() (aq)。列式并计算该反应此温度下的平衡常数K=______________(写出K的表达式、代入数据、算出结果、保留三位有效数字)
(aq)。列式并计算该反应此温度下的平衡常数K=______________(写出K的表达式、代入数据、算出结果、保留三位有效数字)
(6)以石墨为电极电解Pb(NO3)2溶液也可以制得PbO2。PbO2将在__________极生成(填“阴”或“阳”);而另一极存在电极反应Pb2++2e-=Pb,故Pb元素的利用率较低。若在Pb(NO3)2溶液中加入适量Cu(NO3)2则可有效利用Pb2+,其理由是_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组有机化合物中,不论两者以什么比例混合,只要总物质的量一定,则完全燃烧时生成的水的质量和消耗氧气的质量不变的是
A. CH4O,C3H4O5B. C3H6,C3H8O
C. C3H8,C4H6D. C2H6,C4H6O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右下表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素的核电荷数为X元素的2倍。下列说法正确的是( )
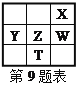
A. X、W、Z元素的原子半径及它们的气态氢化物的热稳定性均依次递增
B. Y、Z、W元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增
C. YX2晶体熔化、液态WX3气化均需克服分子间作用力
D. 根据元素周期律,可以推测T元素的单质具有半导体特性,T2X3具有氧化性和还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应C(s)+H2O(g)![]() CO(g)+H2(g)在一可变容器中进行,下列条件的改变对其速率几乎无影响的是
CO(g)+H2(g)在一可变容器中进行,下列条件的改变对其速率几乎无影响的是
A.增加C的量
B.将容器的体积缩小一半
C.保持体积不变,充水蒸汽使体系压强增大
D.保持压强不变,充氮气使容器体积增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质结构和性质的说法不正确的是
A. 三联苯![]() 与四联苯
与四联苯![]() 互为同系物
互为同系物
B. 分子式为C5H10且与乙烯互为同系物的结构共有5种
C. 可用燃烧法鉴别环己烷、苯、CCl4
D. 分子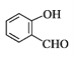 中所有原子可能位于同一平面
中所有原子可能位于同一平面
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com