
【题目】工业上常用(NH4)2SO3溶液吸收废气中的SO2,室温下测得溶液中lgY[Y=![]() 或
或![]() ],与pH的变化关系如图所示。则下列说法一定错误的是( )
],与pH的变化关系如图所示。则下列说法一定错误的是( )
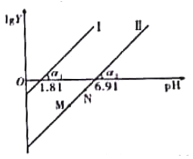
A.通入少量SO2的过程中,直线Ⅱ中的N点向M点移动
B.α1=α2一定等于45°
C.当对应溶液的pH处于1.81<pH<6.91时,溶液中的微粒浓度一定存在c(HSO3-)>c(SO32-)>c(H2SO3)
D.直线Ⅱ中M、N点一定存在c2(HSO3-)>c(SO32-)·c(H2SO3)
科目:高中化学 来源: 题型:
【题目】以铅蓄电池为外电源,Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。已知:铅蓄电池中的总反应方程式为:
Pb(s)+PbO2(s)+2H2SO4(aq)![]() 2PbSO4(s)+2H2O(l)
2PbSO4(s)+2H2O(l)
电解的化学方程式:2Al+3H2O![]() Al2O3+3H2↑
Al2O3+3H2↑
对该电解过程,下列判断错误的是( )
A.电解池:溶液的pH减小
B.电解池:SO42-移向Al电极
C.铅蓄电池:负极质量不变
D.铅蓄电池:工作一段时间后,进行充电时铅蓄电池的负极接电源的负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是实验室制取SO2并验证SO2某些性质的装置图,试回答:
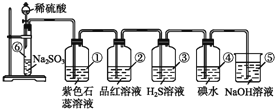
(1)⑥中发生反应的化学方程式为___;
(2)①中实验现象为___,证明SO2是___气体;
(3)②中品红溶液___,证明SO2有___;
(4)③中现象是___,写出SO2与H2O2的化学方程式___;
(5)④中现象是___,证明SO2有___性;
(6)⑤的作用是___,反应的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用质量分数为36.5%的浓盐酸(密度为1.16 g·cm-3)配制成1 mol·L-1的稀盐酸。现实验室仅需要这种盐酸220 mL,试回答下列问题:
(1)配制稀盐酸时,应选用容量为________mL的容量瓶。
(2)在量取浓盐酸时宜选用下列量筒中的________。
A.5 mL B.10 mL C.25 mL D.50 mL
(3)在量取浓盐酸后,进行了下列操作:(将操作补充完整)
①等稀释的盐酸的温度与室温一致后,沿玻璃棒注入容量瓶中。
②往容量瓶中小心加蒸馏水至液面离容量瓶刻度线1~2 cm时,改用胶头滴管加蒸馏水,____________________________________________。
③在盛盐酸的烧杯中注入蒸馏水,并用玻璃棒搅动,使其混合均匀。
④用蒸馏水洗涤烧杯和玻璃棒2~3次,并将洗涤液全部注入容量瓶。
上述操作中,正确的顺序是(填序号)________。
(4)若用1mol/L HCl溶液润洗容量瓶,再转移溶液,所配置的溶液浓度将_________(填“偏大”“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E是原子序数依次增大的五种短周期主族元素,其中B和D同主族,中学阶段常见物质X、Y、Z为其中的三种元素组成的化合物,且均为强电解质,当X、Y按物质的量之比为1:2反应时,有如图转化关系。下列说法正确的是( )

A.C、D、E三种元素一定位于同一周期
B.物质X、Y、Z既含有离子键又含有共价键
C.C和D形成的化合物溶于水,其溶液显中性
D.简单氢化物的热稳定性:D>E
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然气是一种重要的化工原料,其中含有少量H2S羰基硫(COS),能引起催化剂中毒、化学产品质量下降和大气污染。
(1)氨水可以吸收H2S,若生成物是NH4HS,写出反应的离子方程式___。
(2)利用含Fe3+的溶液可以脱除其中的H2S。将H2S和空气按一定流速通酸性FeCl3溶液,可实现空气脱硫得到单质硫。FeCl3溶液吸收H2S过程中,溶液中的n(Fe3+)、被吸收的n(H2S)随时间t变化如图。
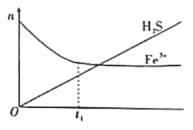
①t1以前,溶液中n(Fe3+)不断减小的原因是___(用离子方程式表示)。
②t1以后,溶液中n(Fe3+)基本保持不变,原因是___。此时,溶液中总反应的离子方程式可以表示为___。
(3)羰基硫的碱性水解是常用的脱硫方法,其流程如图:
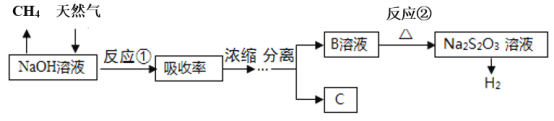
①已知B是硫化钠,C是一种正盐,则B的电子式为___,C的化学式为___。
②写出反应②的离子方程式___。
③如图是反应②中,在不同反应温度下.反应时间与H2产量的关系(Na2S初始含量为3mmol)。由图像分析可知,a点时溶液中除S2O32-外,还有___(填含硫微粒的离子符号)。
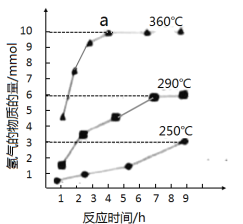
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图装置可作集气瓶和洗气瓶。现有以下5种气体:①Cl2②NH3③NO④NO2⑤SO2 (作答请填序号)。
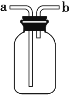
(1)若集气瓶是干燥的,则由b口进气可收集的气体有______。
(2)若集气瓶充满水,可收集的气体有_______;此时气体由______口进入。
(3)若集气瓶内装入浓硫酸进行气体干燥,不能用此装置干燥的气体是____。若干燥时气体由____口进入。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向HCl、AlCl3混合溶液中逐滴加入NaOH溶液,生成沉淀的量随NaOH溶液加入量的变化关系如图所示,则下列离子组在对应的溶液中一定能大量共存的是( )

A. M点对应的溶液中:K+、Fe2+、SO42-、NO3-
B. N点对应的溶液中:K+、NH4+、Cl-、CO32-
C. S点对应的溶液中:Na+、SO42-、HCO3-、NO3-
D. R点对应的溶液中:Na+、SO42-、Cl-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】周期表前四周期的元素![]() 、
、![]() 、
、![]() 、
、![]() ,原子序数依次增大,X原子基态时
,原子序数依次增大,X原子基态时![]() 层中
层中![]() 轨道电子数与s轨道电子数相同;
轨道电子数与s轨道电子数相同;![]() 原子基态时2p原子轨道上有3个未成对的电子;Z有多种氧化物,其中一种红棕色氧化物可作涂料;
原子基态时2p原子轨道上有3个未成对的电子;Z有多种氧化物,其中一种红棕色氧化物可作涂料;![]() 位于第四周期,其原子最外层只有1个电子,且内层都处于全充满状态。回答下列问题:
位于第四周期,其原子最外层只有1个电子,且内层都处于全充满状态。回答下列问题:
(1)X位于周期表的第_______周期,第______族。
(2)元素的第一电离能:X______Y(填“>”或“<”,下同);原子半径:X______Y。
(3)![]() 的最高价氧化物对应水化物中酸根离子的空间构型是_______(用文字描述)。
的最高价氧化物对应水化物中酸根离子的空间构型是_______(用文字描述)。
(4)![]() 基态核外电子排布式为_________,用铁氰化钾溶液检验
基态核外电子排布式为_________,用铁氰化钾溶液检验![]() 的离子方程式为___________。
的离子方程式为___________。
(5)元素W的一种氯化物晶体的晶胞结构如图所示,该氯化物的化学式是_______,它可与浓盐酸发生非氧化还原反应,生成配合物![]() ,反应的化学方程式:_________。
,反应的化学方程式:_________。
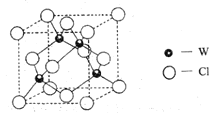
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com