
【题目】下列有关有机物的说法正确的是
A. 分液漏斗可以分离甘油和水的混合物
B. 分子式为C5H10Cl2,结构中含有一个-CH3的同分异构体有7种
C. 由甲苯制取三硝基甲苯的反应与乙酸和苯甲醇反应的类型不同
D. 有机物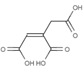 能发生氧化、还原、加成、加聚和取代反应
能发生氧化、还原、加成、加聚和取代反应
【答案】D
【解析】
A.甘油和水互溶,不分层,不能用分液漏斗分离,故A项错误;
B.二氯代物的同分异构体可以采用“定一移一”法解题,先找出所有的同分异构体,再找出只含一个“-CH3”的,其中符合条件的有:CH3-CH2-CH2-CH2-CHCl2,CH3-CH2-CH2-CHCl-CH2Cl,CH3-CH2-CHCl-CH2-CH2Cl,CH3-CHCl-CH2-CH2-CH2Cl,CH3-CH2-CH(CH2Cl)-CH2Cl,CH3-CH(CH2Cl)-CH2-CH2Cl,符合条件的结构简式一共有6个,故B错误;
C.甲苯和浓HNO3在加入催化剂浓硫酸后加热发生取代反应,乙酸和苯甲醇发生酯化反应,酯化反应属于取代反应,都是取代反应,故C项错误;
D.该有机物中含有碳碳双键就能发生氧化、还原、加成、加聚,含有羧基能发生取代反应,D正确;
故答案选D。


 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
【题目】化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。下图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化。
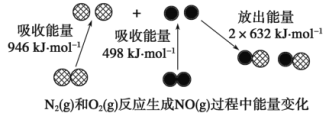
下列说法正确的是
A.1 mol N2(g)和1 mol O2(g)反应放出的能量为180 kJ
B.1molN2(g)和1molO2(g)具有的总能量小于2molNO(g)具有的总能量
C.通常情况下,N2(g)和O2(g)混合能直接生成NO
D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)上海白龙港污水处理厂升级改造,处理废水时加入明矾可作为混凝剂以吸附水中的杂质,利用漂白粉可用来杀菌消毒,工业上利用氯气和石灰乳制取漂白粉的化学反应方程式是___________,其中___________是漂白粉的有效成分;
(2)生产硅酸盐水泥和普通玻璃都需要用到的主要原料是__________(填名称);
(3)在雷电作用下,大气中游离态的氮会少量转化为化合态的氮并随雨水落下,这是自然中固定氮的途径之一。用化学方程式表示上述过程。________,_______,______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以含银废液{主要含[Ag(NH3)2]+、[Ag(S2O3)2]3-}为原料制取硝酸银晶体,其实验流程如下:

已知:①“沉银”所得AgCl中含有少量PbCl2、Ag2S。
②Zn2+在浓氨水中以[Zn(NH3)4]2+形式存在。
③PbCl2、AgNO3的溶解度曲线如图所示:

(1)“滤液”中的主要阳离子为___(填化学式)。
(2)“除杂”分为两步:先除去PbCl2,再除去Ag2S。
①在不同温度下,AgCl、Ag2S均难溶于水。 除去PbCl2的操作为______,热水洗涤。
②向热水洗涤所得固体中加入浓硝酸和稀盐酸,边加热边充分搅拌,使Ag2S转变为AgCl。加入浓硝酸的目的是_______。
(3)室温下,可逆反应AgCl+2NH3·H2O[Ag(NH3)2]++Cl-+2H2O的平衡常数K=___。{Ksp(AgCl)= 1.8×10-10,Ag++2NH3·H2O[Ag(NH3)2]++2H2O的平衡常数为1.1×107}
(4)“还原”过程中发生反应的离子方程式为_____ 。
(5)粗银经水洗后,经多步处理可制备硝酸银晶体。请补充完整由以水洗后粗银为原料,制备硝酸银晶体的实验方案:________,过滤,________,将产生的气体和空气混合后通入NaOH溶液进行尾气处理,将所得AgNO3溶液_______,过滤,将所得晶体置于烘箱 (120℃)干燥,密封包装。(实验中须使用的试剂:稀硫酸、稀硝酸、BaC12溶液)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一体积2L的密闭容器中加入反应物N2、H2,发生如下反应:N2(g)+3H2(g)![]() 2NH3(g)。反应过程中的部分数据如下表所示,下列说法正确的是
2NH3(g)。反应过程中的部分数据如下表所示,下列说法正确的是
物质的量/ mol 时间/min | n(N2) | n(H2) | n(NH3) |
0 | 1.0 | 1.2 | 0 |
2 | 0.9 | ||
4 | 0.75 | ||
6 | 0.3 |
A. 0~2 min内,NH3的反应速率为0.1 mol·Lˉ1·minˉ1
B. 2 min时, H2的物质的量0.3 mol
C. 4 min时,反应已达到平衡状态,此时正、逆反应的速率都为0
D. 4~6 min内,容器内气体分子的总物质的量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是:600℃ 时,在2L密闭容器里A、B、C三种气体在密闭容器中反应时浓度的变化,其中A为有色气体,B、C是无色气体。请从图中分析并填空:
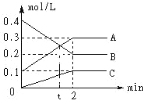
(1)该反应的化学反应方程式为_____
(2)反应达到平衡状态时,反应物的转化率为_____
(3)当反应进行到第_____min,该反应达到平衡。
(4)反应从开始至2分钟末,B的物质的量_____,用B的浓度变化表示的平均反应速率为v(B)=_
(5)下列描述能表示反应达平衡状态的是_____(填选项)。
a.容器中A与B的物质的量相等
b.容器内气体的颜色不再改变
c.各物质的浓度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、实验室里用乙醇和浓硫酸反应生成乙烯,乙烯再与溴反应制1,2 -二溴乙烷。在制备过程中部分乙醇被浓硫酸氧化,产生CO2、SO2,并进而与溴反应生成HBr等酸性气体。
(1)用下列仪器,以上述三种物质为原料制备1,2一二溴乙烷。如果气体流向为从左到右,正确的连接顺序是(短接口或橡皮管均已略去):B经A①插人A中,D接A②;A③接_______接_____接_____接______。
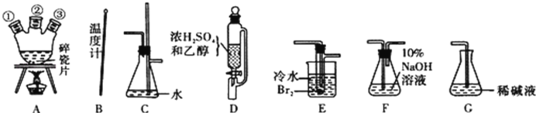
(2)装置C的作用是________________;
(3)在反应管E中进行的主要反应的化学方程式为____________________;
Ⅱ、某兴趣小组同学在实验室用加热l-丁醇、浓H2SO4和溴化钠混合物的方法来制备1-溴丁烷,设计了如下图所示的实验装置(其中的夹持仪器没有画出)。

请回答下列问题:
(1)两个装置中都用到了冷凝管,A装置中冷水从_________(填字母代号)进入,B装置中冷水从________(填字母代号)进入。
(2)制备操作中,加入的浓硫酸事先稍须进行稀释,其目的是________。(填字母)
a.减少副产物烯和醚的生成 b.减少Br2的生成 c.水是反应的催化剂
(3)为了进一步提纯1-溴丁烷,该小组同学查得相关有机物的有关数据如下表:
物质 | 熔点/℃ | 沸点/℃ |
1-丁醇 | -89.5 | 117.3 |
1-溴丁烷 | -112.4 | 101.6 |
丁醚 | -95.3 | 142.4 |
1-丁烯 | -185.3 | -6.5 |
则用B装置完成此提纯实验时,实验中要迅速升高温度至_________收集所得馏分。
(4)有同学拟通过红外光谱仪鉴定所得产物中是否含有“-CH2CH2CH2CH3”,来确定副产物中是否存在丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3)。请评价该同学设计的鉴定方案是否合理?________为什么?答:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值。硫化钠广泛应用于冶金染料、皮革、电镀等工业。硫化钠的一种制备方法是Na2SO4+2C![]() Na2S+2CO2↑。下列说法正确的是
Na2S+2CO2↑。下列说法正确的是
A.4.2g14C原子含中子数目为1.8NA
B.1L0.1mol/LNa2S溶液中含阴离子的数目小于0.1NA
C.该反应中,若生成1mol氧化产物,转移电子数目为4NA
D.常温下2.24LCO2中共用电子对数目为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。铟与铷(37Rb)同周期。下列说法不正确的是
A. In是第五周期第ⅢA族元素
B. 11549In的中子数与电子数的差值为17
C. 原子半径:In>Al
D. 碱性:In(OH)3>RbOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com