
【题目】(1)上海白龙港污水处理厂升级改造,处理废水时加入明矾可作为混凝剂以吸附水中的杂质,利用漂白粉可用来杀菌消毒,工业上利用氯气和石灰乳制取漂白粉的化学反应方程式是___________,其中___________是漂白粉的有效成分;
(2)生产硅酸盐水泥和普通玻璃都需要用到的主要原料是__________(填名称);
(3)在雷电作用下,大气中游离态的氮会少量转化为化合态的氮并随雨水落下,这是自然中固定氮的途径之一。用化学方程式表示上述过程。________,_______,______。
【答案】2Ca(OH)2+2Cl2══CaCl2+ Ca(ClO)2+2H2O Ca(ClO)2 石灰石 N2+O2![]() 2NO 2NO+O2 = 2NO2 3NO2+H2O = 2HNO3+NO
2NO 2NO+O2 = 2NO2 3NO2+H2O = 2HNO3+NO
【解析】
(1)氯气和石灰乳反应生成氯化钙、次氯酸钙、水,次氯酸钙与水、二氧化碳反应生成HClO,具有杀菌消毒作用,据此分析解答;
(2)根据制备水泥和玻璃的原料分析;
(3)在雷电作用下,氮气和氧气直接化合生成一氧化氮气体,一氧化氮很容易与空气中的氧气结合生成二氧化氮气体,二氧化氮溶于水生成硝酸和一氧化氮,据此书写方程式。
(1)氯气和石灰乳反应生成氯化钙、次氯酸钙、水,该反应的化学方程式为2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O,其中有效成分为Ca(ClO)2,故答案为: 2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O;Ca(ClO)2;
(2)制备水泥的原料是粘土、石灰石;制备玻璃的原料是纯碱、石灰石、石英,所以都用到的原料为石灰石,故答案为:石灰石;
(3)在雷电作用下,氮气和氧气直接化合生成一氧化氮气体:N2+O2 ![]() 2NO;一氧化氮很容易与空气中的氧气结合生成二氧化氮气体:2NO+O2=2NO2;二氧化氮溶于水生成硝酸和一氧化氮:3NO2+H2O=2HNO3+NO,生成的硝酸随雨水降落到大地,故答案为:N2+O2
2NO;一氧化氮很容易与空气中的氧气结合生成二氧化氮气体:2NO+O2=2NO2;二氧化氮溶于水生成硝酸和一氧化氮:3NO2+H2O=2HNO3+NO,生成的硝酸随雨水降落到大地,故答案为:N2+O2 ![]() 2NO;2NO+O2=2NO2;3NO2+H2O=2HNO3+NO。
2NO;2NO+O2=2NO2;3NO2+H2O=2HNO3+NO。


科目:高中化学 来源: 题型:
【题目】丙烷的分子结构可简写成键线式结构![]() ,有机物A的键线式结构为
,有机物A的键线式结构为![]() ,有机物B与等物质的量的H2发生加成反应可得到有机物A。下列有关说法错误的是( )
,有机物B与等物质的量的H2发生加成反应可得到有机物A。下列有关说法错误的是( )
A. 用系统命名法命名有机物A,名称为2,2,3﹣三甲基戊烷
B. 有机物A的一氯取代物只有4种
C. 有机物A的分子式为C8H18
D. B的结构可能有3种,其中一种名称为3,4,4﹣三甲基﹣2﹣戊烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:

(1)除去粗盐中杂质(Mg2+、SO![]() 、Ca2+ ),加入的药品顺序正确的是______ ( 填字母);
、Ca2+ ),加入的药品顺序正确的是______ ( 填字母);
A.NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸
B.BaCl2溶液→NaOH溶液→Na2CO3溶液→过滤后加盐酸
C.NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤后加盐酸
D.Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
(2)制备钠单质的方法之一是将熔融NaCl进行电解,写出电解化学方程式:________________;
(3)步骤I中已获得Br2,步骤I中又将Br2还原为Br- ,其目的是_________________,写出步骤II中发生反应的化学方程式:_______________________;
(4)某化学小组的同学为了了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性。他们参观生产过程后,设计了如下实验装置:

①图中仪器B的名称是_________________________________;
②C中收集到液体的颜色为__________________________________;
③Br2被过量Na2CO3溶液吸收的氧化产物为NaBrO3,则D中发生反应的化学方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列说法中正确的是 ( )
A. 常温常压下,0.05 NA个CO2分子所占的体积是1.12 L
B. 1 mol氧气含有氧原子数为NA
C. 常温常压下,32g氧气和34 g H2S分子个数比为1∶1
D. 标准状况下,NA个水分子所占的体积为22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的Cu粉与浓H2SO4共热产生SO2气体的体积为2.24 L(标准状况下),则下列情况不可能的是( )
A.加入Cu的质量为6.4 g
B.加入的浓H2SO4中含溶质0.2 mol
C.加入Cu的质量大于6.4 g
D.加入浓H2SO4中含溶质多于0.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应 2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2 可用于工业上制备 Na2S2O3。下列化学用语表示正确的是
A.中子数为20的硫原子:![]() S
S
B.Na+的结构示意图: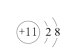
C.Na2S的电子式:![]()
D.CO32-水解的离子方程式 CO32-+2H2O=H2CO3+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaBH4是一种常见的还原剂。一种以H2、Na、硼酸三甲酯[B(OCH3)3]为原料,生产NaBH4的工艺流程如下:
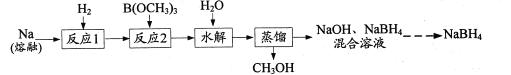
(1)下列措施能提高“反应1”的化学反应速率的有______(填字母)。
A.充分搅拌熔融钠
B.将熔融钠充分分散在石蜡油中
C.反应前排尽装置中的空气
(2)在浓硫酸作用下,B(OCH3)3可由B(OH)3和CH3OH发生酯化反应制得。浓H2SO4的作用是_____。
(3)“反应2”在240℃条件下进行,生成的产物是NaBH4和CH3ONa,写出该反应的化学方程式:____ 。“反应2”所用B(OCH3)3需充分干燥,原因是______。
(4)反应NaBH4+2H2O=NaBO2+4H2 可用于制取H2。一定浓度的NaBH4催化制氢的半衰期(溶液中NaBH4消耗一半时所需的时间)与溶液pH的关系如图所示:
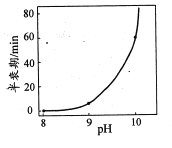
①NaBH4与水反应所得溶液呈碱性,原因是____。
②随着反应的进行,生成H2的速率逐渐减慢,原因是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机物的说法正确的是
A. 分液漏斗可以分离甘油和水的混合物
B. 分子式为C5H10Cl2,结构中含有一个-CH3的同分异构体有7种
C. 由甲苯制取三硝基甲苯的反应与乙酸和苯甲醇反应的类型不同
D. 有机物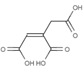 能发生氧化、还原、加成、加聚和取代反应
能发生氧化、还原、加成、加聚和取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠是一种防腐剂和增色剂,但在食品中过量时会对人体产生危害,其在酸性条件下会产生NO和NO2。下列有关说法错误的是
A. NaNO2既可以使酸性高锰酸钾溶液褪色,又可以将二价铁离子氧化为三价铁离子
B. 食用“醋熘豆芽”可能会减少亚硝酸钠对人体的危害
C. NaNO2和胃酸作用的离子方程式为2NO2-+2H+![]() NO↑+NO2↑+H2O
NO↑+NO2↑+H2O
D. 1 mol NaNO2在酸性条件下完全反应生成NO和NO2,转移电子的物质的量为1 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com