
【题目】已知镁在空气中燃烧主要生成氧化镁,同时还会与氮气反应生成微量的氮化镁(Mg3N2)在周期表中,镁与锂;铍与铝处于对角线上,处于对角线上的主族元素性质相 似,这称为对角线规则。据此请回答:
(1)锂在空气中燃烧主要产物的电子式是_____________同时生成微量的________。(写化学式)
(2)铍的最高价氧化物对应的水化物的化学式是_________________,它属两性化合物,证明这一结论的有关离子方程式为____________________,_____________________。
(3)若已知反应Be2C+4H2O===2Be(OH)2+CH4↑,则Al4C3遇强碱溶液反应的离子方程式为____________________________。
(4)用电子式表示BeCl2的形成过程:________________________________________。
【答案】![]() Li3N Be(OH)2 BeO+2OH-===BeO22-+H2O Be(OH)2+2H+===Be2++2H2O Al4C3+4OH- +4H2O===4AlO2-+ 3CH4↑
Li3N Be(OH)2 BeO+2OH-===BeO22-+H2O Be(OH)2+2H+===Be2++2H2O Al4C3+4OH- +4H2O===4AlO2-+ 3CH4↑ ![]()
【解析】
(1)Mg能与空气中的氧气、氮气、二氧化碳反应,类比迁移,则锂在空气中燃烧的产物有Li2O和Li3N,Li2O为主要产物,属于离子化合物,电子式为![]() ,
,
故答案为![]() ;Li3N;
;Li3N;
(2)Be的化合价是+2,铍的最高价氧化物对应的水化物的化学式为Be(OH)2,根据两性氢氧化物既能与酸反应生成盐和水,又能和碱(强碱)反应生成盐和水.Be(OH)2代表碱时为二元碱,Be(OH)2代表酸时为二元酸,表示碱时:Be(OH)2+2H+===Be2++2H2O,表示酸时:Be(OH)2+2OH-===BeO22-+2H2O,
故答案为Be(OH)2;Be(OH)2+2H+===Be2++2H2O;Be(OH)2+2OH-===BeO22-+2H2O;
(3)根据化合价可知,Al4C3水解生成氢氧化铝与甲烷,氢氧化铝再与氢氧化钠反应生成偏铝酸钠,反应的离子方程式为:Al4C3+4OH- +4H2O===4AlO2-+3CH4↑,
故答案为Al4C3+4OH-+4H2O===4AlO2-+3CH4↑;
(4)用电子式表示BeCl2的形成过程的为:![]() ,
,
故答案为 ![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列各组反应中,属于可逆反应的一组是( )
A. 2H2O![]() 2H2↑+O2↑,2H2+O2
2H2↑+O2↑,2H2+O2![]() 2H2O
2H2O
B. NH3+CO2+H2O=NH4HCO3,NH4HCO3![]() NH3↑+H2O↑+CO2↑
NH3↑+H2O↑+CO2↑
C. H2+I2![]() 2HI,2HI
2HI,2HI![]() H2↑+I2↑
H2↑+I2↑
D. 2Ag+Br2![]() 2AgBr,2AgBr
2AgBr,2AgBr![]() 2Ag+Br2
2Ag+Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将32.64g铜与140 mL一定浓度的硝酸反应,铜完全溶解,产生的NO和NO2混合气体在标准状况下的体积为11.2L。请计算(写出计算过程):
(1)混合气体中NO和NO2的体积各位多少?______________
(2)被还原的硝酸的物质的量为多少?_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国化学家研究的一种新型复合光催化剂[碳纳米点(CQDs)/氮化碳(C3N4)纳米复合物]可以利用太阳光实现高效分解水,其原理如图所示。下列说法正确的是

A. C3N4中C的化合价为 -4
B. 反应的两个阶段均为吸热过程
C. 阶段Ⅱ中,H2O2既是氧化剂,又是还原剂
D. 通过该反应,实现了化学能向太阳能的转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下分别向20.00 mL 0.1000 mol·L-1的氨水、醋酸铵溶液中滴加0.1000mol·L-1的盐酸,溶液pH与加入盐酸体积的变化关系如图所示。下列说法正确的是

A. M点溶液中c (OH-)>c(NH4+)>c(NH3·H2O)>c(H+)
B. N点溶液中c(NH4+)>c(NH3·H2O)>c(Cl-)>c(OH-)
C. P点溶液中c(NH4+)>2c(CH3COO-)+c(NH3·H2O)
D. Q点溶液中2c(Cl-)>c(CH3COOH)+c(NH4+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y均为有刺激性气味的气体,且几种物质间有以下转化关系,部分产物未标出。请回答下列问题。
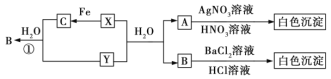
(1)写出下列各物质的化学式:
X______、Y______、A______、B______、C______。
(2)反应①的离子方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,物质之间通过一步反应就能实现如图所示变化的是( )
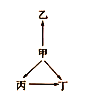
选项 | 甲 | 乙 | 丙 | 丁 |
A | N2 | NH3 | NO | NO2 |
B | Na | Na2O | NaOH | Na2O2 |
C | Fe | Fe3O4 | FeCl2 | FeCl3 |
D | S | FeS | SO2 | SO3 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从元素化合价和物质类别两个角度研究物质的性质是一种行之有效的方法。如图是由铁元素组成的物质的部分信息。

(1)写出X的化学式:___。
(2)FeO与稀硫酸反应的离子方程式:___。Y物质在空气中变化的化学方程式并标出电子转移___。
(3)FeCl2既具有氧化性也具有还原性,分别写出体现其氧化性、还原性的离子方程式(一个即可)。
离子方程式 | |
氧化性 | ___ |
还原性 | ___ |
(4)某同学猜测Fe3+可以与S2-发生反应,为验证其猜测,他结合资料信息,选择了两种试剂进行实验,确认了Fe3+与S2-能发生反应。
资料:部分硫化物的溶解性表(室温)
化学式 | 溶解性 |
Na2S | 可溶 |
Fe2S3 | 不溶,在热水或酸中分解 |
FeS | 不溶 |
选取的试剂是___和___;可能发生的两种不同原理的反应的离子方程式是__、__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲乙两烧杯中各盛有100mL3mol/L的盐酸和NaOH溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为甲:乙=2:3,则加入铝粉的质量为( )
A.1.8gB.2.7gC.4.05gD.5.4g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com