
【题目】下列做法的目的与反应速率有关的是
A. 用冰箱冷藏食物B. 制作糖果过程中添加着色剂
C. 食盐中添加碘酸钾D. 制作糕点时加白糖
科目:高中化学 来源: 题型:
【题目】亚氯酸钠( NaClO2)是一种高效氧化剂、漂白剂,主要用于棉纺、亚麻、纸浆漂白、水处理、杀菌灭藻、鱼药制造等行业。工业上可采用过氧化氢法,即在碱性条件下,用H2O2还原ClO2制备 NaClO2。某兴趣小组模拟工业生产流程在实验室中制备NaClO2,实验装置如图1所示。回答下列问题:
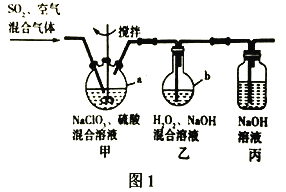
已知:纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
①检査装置气密性;②称取10.65 g NaClO3加入200mL稀硫酸中,溶解,然后转移到仪器a中;③量取适量H2O2加入100 mL NaOH浓溶液中,摇匀后转移到仪器b中;④连接好装置进行实验。
(1)装置甲中空气并不参与反应,则装置甲中发生反应的离子方程式是___________。
(2)进行实验时,需要对装置甲进行水浴加热,水浴加热的优点是________________。
(3)装置丙的作用是_______________________________________________________。
(4)装置乙中制取 NaClO2的离子方程式_________________________________。
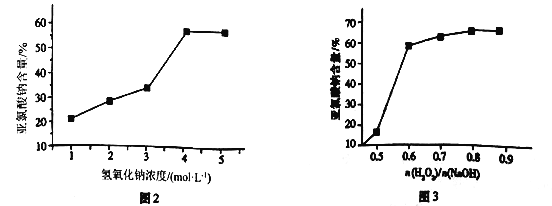
(5)仪器b中的溶质浓度对产品含量起到关键作用,溶质浓度对产品含量的影响如图2和图3所示。结合两图信息,此时混合液中n(H2O2)/n(NaOH)=___________时为最佳,且H2O2的浓度为___________mol·L-1,其可能原因是_________________________________。
(6)实验结束后,在适当的条件下处理b中的混合液,得到产品NaClO2·3H2O 9.39g。该实验的产率为___________。(保留3位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在某密闭容器中进行如下反应:

mA(g)+nB(g)![]() pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,
pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,
反应速率随时间的变化过程如图所示,则对该反应的叙述正确的是( )
A. 正反应是吸热反应 B. 逆反应是放热反应
C. m+n<p+q D. m+n>p+q
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在14.2g硫酸钠中:
(1)含有的Na+的数目是_________;
(2)含有的SO42-的质量是________;
(3)含氧原子的物质的量是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了测定黄铜(铜、锌合金)中铜的质量分数,取20g黄铜样品加入大烧杯中,把200g稀盐酸分四次加入,实验所得数据如下表:
实验次数 | 第一次 | 第二次 | 第三次 | 第四次 |
加入稀盐酸质量/g | 50 | 50 | 50 | 50 |
剩余固体的质量/g | 16.75 | 13.5 | m | 12.2 |
计算:
(1)表中m=______。
(2)黄铜样品中铜的质量分数为多少?(写出计算过程)______
(3)反应总共产生气体的物质的量是多少?(写出计算过程)_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在水溶液中一定能大量共存的是( )
A. 含有大量 Ba2+的溶液中:Cl- K+ ![]()
![]()
B. 含有大量H+的溶液中:Mg2+ Na+ ![]()
![]()
C. 含有大量OH-的溶液中:Mg2+ ![]()
![]()
![]()
D. 含有大量Na+的溶液中:H+ K+ ![]()
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁炭混合物(铁屑和活性炭的混合物)、纳米铁粉均可用于处理水中污染物。
(1)铁炭混合物在水溶液中可形成许多微电池。将含有Cr2O72-的酸性废水通过铁炭混合物,在微电池正极上Cr2O72-转化为Cr3+,其电极反应式为_____________。
(2)在相同条件下,测量总质量相同、铁的质量分数不同的铁炭混合物对水中Cu2+和Pb2+的去除率,结果如右图所示。

①当铁炭混合物中铁的质量分数为0时,也能去除水中少量的Cu2+和Pb2+,其原因是__________。
②当铁炭混合物中铁的质量分数大于50%时,随着铁的质量分数的增加,Cu2+和Pb2+的去除率不升反降,其主要原因是_____________。
(3)纳米铁粉可用于处理地下水中的污染物。
①一定条件下,向FeSO4溶液中滴加碱性NaBH4溶液,溶液中BH4-(B元素的化合价为+3)与Fe2+反应生成纳米铁粉、H2和B(OH)4-,其离子方程式为 。
②纳米铁粉与水中NO3-反应的离子方程式为 4Fe+ NO3-+10H+=4Fe2++NH4++3H2O,研究发现,若pH偏低将会导致NO3-的去除率下降,其原因是 。
③相同条件下,纳米铁粉去除不同水样中NO3-的速率有较大差异(见右图),产生该差异的可能原因是 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第三周期元素X、Y、Z、W的最高价氧化物溶于水可得四种溶液,0.010mol/L的这四种溶液pH与该元素原子半径的关系如下图所示。下列说法正确的是

A. 简单离子半径:X>Y>Z>W
B. X和Y的最高价氧化物对应的水化物恰好中和时,溶液呈中性
C. 气态氢化物的稳定性:Z>W>Y
D. Y元素存在同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A+、B-、C三种短周期元素的粒子具有相同的电子层结构,则关于它们的叙述正确的是
A.原子序数:C>B>AB.离子半径:B-<A+C.C是稀有气体元素的原子D.原子半径:A<B
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com