
【题目】亚氯酸钠( NaClO2)是一种高效氧化剂、漂白剂,主要用于棉纺、亚麻、纸浆漂白、水处理、杀菌灭藻、鱼药制造等行业。工业上可采用过氧化氢法,即在碱性条件下,用H2O2还原ClO2制备 NaClO2。某兴趣小组模拟工业生产流程在实验室中制备NaClO2,实验装置如图1所示。回答下列问题:
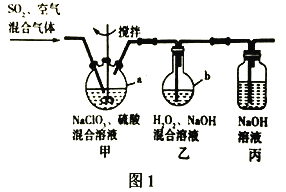
已知:纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
①检査装置气密性;②称取10.65 g NaClO3加入200mL稀硫酸中,溶解,然后转移到仪器a中;③量取适量H2O2加入100 mL NaOH浓溶液中,摇匀后转移到仪器b中;④连接好装置进行实验。
(1)装置甲中空气并不参与反应,则装置甲中发生反应的离子方程式是___________。
(2)进行实验时,需要对装置甲进行水浴加热,水浴加热的优点是________________。
(3)装置丙的作用是_______________________________________________________。
(4)装置乙中制取 NaClO2的离子方程式_________________________________。
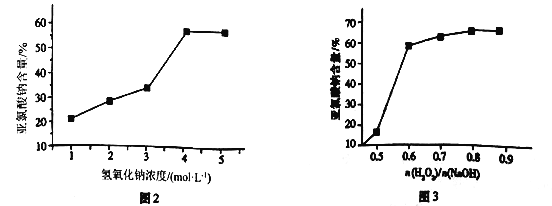
(5)仪器b中的溶质浓度对产品含量起到关键作用,溶质浓度对产品含量的影响如图2和图3所示。结合两图信息,此时混合液中n(H2O2)/n(NaOH)=___________时为最佳,且H2O2的浓度为___________mol·L-1,其可能原因是_________________________________。
(6)实验结束后,在适当的条件下处理b中的混合液,得到产品NaClO2·3H2O 9.39g。该实验的产率为___________。(保留3位有效数字)
【答案】SO2+2ClO3-=2ClO2+SO42- 受热均匀,便于控制温度 吸收ClO2等有害气体,防止污染环境 H2O2+2ClO2+2OH-=2ClO2-+O2+2H2O 0.6 2.4 该反应为放热反应,会造成H2O2分解(或者过量的SO2会还原H2O2),所以n(H2O2)/n(NaOH)稍大于0.5,当超过0.6时,NaClO2%变化不大,考虑经济因素,选择比值为0.6时为最佳 65.0%
【解析】
(1)装置甲利用NaClO3和Na2SO3在稀硫酸的酸化下,产生ClO2和硫酸钠,据此写出发生反应的离子方程式;
(2)水浴加热的优点是受热均匀,便于控制温度;
(3)ClO2为有害气体,所以装置丙的作用是吸收ClO2等有害气体,防止污染环境;
(4)装置乙中利用ClO2和H2O2在碱性条件下制备NaClO2,据此写出发生反应的离子方程式;
(5)由图3可知,n(H2O2)/n(NaOH) 为0.6时,NaClO2%达到60%,当超过0.6时,NaClO2%变化不大,考虑经济因素,选择比值为0.6时为最佳;由图2可知,此时c(NaOH)=4mol/L,
则H2O2的浓度为4 mol·L-1×0.6=2.4mol·L-1;
(6)先根据NaClO3~NaClO2·3H2O计算出理论上可制得NaClO2·3H2O的质量,再根据产率=![]() ×100%计算产率。
×100%计算产率。
(1)装置甲利用NaClO3和Na2SO3在稀硫酸的酸化下,产生ClO2和硫酸钠,发生反应的离子方程式是SO2+2ClO3-=2ClO2+SO42-;
因此,本题正确答案为:SO2+2ClO3-=2ClO2+SO42-;
(2)水浴加热的优点是受热均匀,便于控制温度;
因此,本题正确答案为:受热均匀,便于控制温度
(3)ClO2为有害气体,所以装置丙的作用是吸收ClO2等有害气体,防止污染环境;
因此,本题正确答案为:吸收ClO2等有害气体,防止污染环境;
(4)装置乙中利用ClO2和H2O2在碱性条件下制备NaClO2,其中ClO2是氧化剂,H2O2的氧化产物是O2,发生反应的离子方程式为H2O2+2ClO2+2OH-=2ClO2-+O2+2H2O;
因此,本题正确答案为:H2O2+2ClO2+2OH-=2ClO2-+O2+2H2O;
(5)由图3可知,n(H2O2)/n(NaOH) 为0.6时,NaClO2%达到60%,当超过0.6时,NaClO2%变化不大,考虑经济因素,选择比值为0.6时为最佳,由图2可知,此时c(NaOH)=4mol/L,
则H2O2的浓度为4 mol·L-1×0.6=2.4mol·L-1;
因此,本题正确答案为:0.6;2.4;该反应为放热反应,会造成H2O2分解(或者过量的SO2会还原H2O2),所以n(H2O2)/n(NaOH)稍大于0.5,当超过0.6时,NaClO2%变化不大,考虑经济因素,选择比值为0.6时为最佳;
(6)10.65 g NaClO3的物质的量为![]() =0.1mol,根据NaClO3~NaClO2·3H2O,
=0.1mol,根据NaClO3~NaClO2·3H2O,
理论上可制得NaClO2·3H2O的质量为0.1mol×144.5g/mol=14.45g,
该实验的产率为![]() ×100%=65.0%,
×100%=65.0%,
因此,本题正确答案为:65.0%。


科目:高中化学 来源: 题型:
【题目】(1)材料是人类赖以生存和发展的重要物质基础。
①水泥是最常用的建筑材料,它属于________(填字母)。
a. 金属材料 b. 无机非金属材料 c. 有机高分子材料
②下列硅酸盐产品的生产原料中不需要石灰石的是________(填字母)。
a. 陶瓷 b. 水泥 c. 玻璃
③高岭土是烧制瓷器的重要原料,其组成可以表示为Al2Si2Ox(OH)y,其中x,y的数值分别是________(填字母)。
a. 5、4 b. 6、3 c. 7、2
④下列物品的构成材料中主要是合成高分子材料的是________(填字母)。
a. 宣纸 b. 羊毛衫 c. 保鲜膜
⑤橡胶是制造轮胎的主要原料,天然橡胶是________结构(填“线型”或“体型”),需经过硫化处理改变其结构,增强其机械强度。
(2)某品牌果冻标签如图所示。回答下列问题:

①食品添加剂中,属于无机盐的是______(填化学式)。
②属于着色剂的是诱惑红和______;属于防腐剂的是______。
③配料表中白砂糖的成分是蔗糖,请写出蔗糖在人体内水解的化学方程式______。
(3)化学与科学技术、生产生活及环境保护等密切相关。
①2016年12月我省启动了保卫碧水蓝天的“263”行动,减少煤炭消费总量,减少雾霾天气的发生。形成硫酸型酸雨的主要气体是______;严格整治畜禽养殖场污染,主要是为减少______和P等元素及化学需氧量对水体的污染。
②目前正在推广用尿素水解液来消除柴油汽车尾气中的氮氧化物。写出尿素水解液中的NH3与NO在催化剂作用下,反应生成无污染物质的化学方程式____________________________________________________。
③阿司匹林作为一种药物,主要具有______作用;Mg2Si3O8·nH2O(三硅酸镁)具有治疗胃酸过多的作用,写出其与胃酸反应生成SiO2 ·H2O等物质的化学方程式___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题(每空2分,共10分):
(1)由乙醛(CH3CHO),乙炔(C2H2),苯(C6H6)组成的混合物中,碳的质量分数为72%,则氧的质量分数为___________(保留三位有效数字)
(2)下列服装所使用的材料中,属于有机合成材料的是________(选填字母)
a.纯棉帽子 b.羊毛衫 c.涤纶运动裤
(3)能用洗洁精除去餐具上的油污,是因为洗洁精在水中对油污具有_________作用。
(4)房屋装修后,可在室内放一些活性炭来吸收装修材料释放出的甲醛等有毒气体,这是利用活性炭的__________性。
(5)3~5公里短途出行不开私家燃油车,使用电动自行车,有利于减少环境污染。电动自行车行驶时电池将__________能转化为电能。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯水中含有多种成分,因而具有多种性质,根据氯水分别与如图四种物质发生的反应填空(a、b、c、d中重合部分代表物质间反应,且氯水足量)。

(1)能证明氯水具有漂白性的是______(填“a”“b”“c”或“d”)。
(2)c过程中的现象是_____,b过程中的化学方程式为_____。
(3)久置的氯水变为____,用化学反应方程式表示为______。
(4)实验室保存饱和氯水的方法是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是碳酸钙(CaCO3)在25 ℃和100 ℃两种情况下,在水中的溶解平衡曲线。下列有关说法正确的是

A. CaCO3(s)![]() Ca2+(aq)+ CO32-(aq) ΔH<0
Ca2+(aq)+ CO32-(aq) ΔH<0
B. a、b、c、d四点对应的溶度积Ksp相等
C. 温度不变,蒸发水,可使溶液由a点变到c点
D. 25 ℃时,CaCO3的Ksp=2.8×10-9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酸的酸式盐NaHY的水溶液中,HY-的电离程度小于HY-的水解程度,有关叙述中正确的是
A. H2Y在电离时为:H2Y+H2O ![]() HY-+H3O+
HY-+H3O+
B. 在该盐的溶液中,离子浓度为:c(Na+)>c(Y2-)>c(HY-)>c(OH-)>c(H+)
C. 在该盐的溶液中,离子浓度为:c(Na+)>c(HY-)>c(Y2-)>c(OH-)>c(H+)
D. HY-的水解方程式为:HY-+H2O ![]() H3O++Y2-
H3O++Y2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2CO(g)+O2(g)=2CO2(g)ΔH=-566kJ/mol
Na2O2(s)+CO2(g)=Na2CO3(s)+![]() O2(g)ΔH=-226kJ/mol
O2(g)ΔH=-226kJ/mol
根据以上热化学方程式判断,下列说法正确的是
A. CO的燃烧热为283 kJ
B. 如图可表示由CO生成CO2的反应过程和能量关系
C. 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>-452 kJ/mol
D. CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com