
【题目】氯水中含有多种成分,因而具有多种性质,根据氯水分别与如图四种物质发生的反应填空(a、b、c、d中重合部分代表物质间反应,且氯水足量)。

(1)能证明氯水具有漂白性的是______(填“a”“b”“c”或“d”)。
(2)c过程中的现象是_____,b过程中的化学方程式为_____。
(3)久置的氯水变为____,用化学反应方程式表示为______。
(4)实验室保存饱和氯水的方法是_____。
【答案】d 有白色沉淀生成 Na2CO3+2HCl=2NaCl+H2O+CO2↑ 稀盐酸 2HClO![]() 2HCl+O2↑ 在阴凉处置于棕色试剂瓶中密封保存
2HCl+O2↑ 在阴凉处置于棕色试剂瓶中密封保存
【解析】
将氯气溶于水,部分氯气与水反应生成盐酸和次氯酸,得到浅黄绿色的氯水,氯水含有H2O、Cl2、HClO、Cl-、H+、OH-(极少量,水微弱电离出来的)多种微粒,其性质取决于其组成的微粒。
(1)氯水中HClO具有强氧化性,能使有机色质漂白脱色而表现漂白性,故答案为:d;
(2)氯水中含有Cl-离子,能与AgNO3溶液反应生成白色的氯化银沉淀;氯水中含有酸性强于碳酸的盐酸,能与Na2CO3溶液发生反应生成氯化钠、二氧化碳和水,故答案为:有白色沉淀生成;Na2CO3+2HCl=2NaCl+H2O+CO2↑;
(3)氯水中HClO不稳定,见光易分解生成盐酸和氧气,溶液的颜色由浅绿色变为无色,反应的化学方程式为2HClO![]() 2HCl+O2↑,故答案为:稀盐酸;2HClO
2HCl+O2↑,故答案为:稀盐酸;2HClO![]() 2HCl+O2↑;
2HCl+O2↑;
(4)为防止氯水中HClO见光易分解,应将新制的饱和氯水在阴凉处置于棕色试剂瓶中密封保存,故答案为:在阴凉处置于棕色试剂瓶中密封保存。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 将饱和FeCl3溶液滴入沸水中制胶体,离子方程式:Fe3++3H2O![]() Fe(OH)3 ↓+3H+
Fe(OH)3 ↓+3H+
B. 为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸
C. 自发进行的反应可能是熵增大且吸热的反应
D. 升温时,若某可逆反应化学平衡常数K值变小,则表明该反应的ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A. 锌与CH3COOH溶液反应:Zn+2H+===Zn2++H2↑
B. 氢氧化铝与稀硝酸反应:H++OH-===H2O
C. CuCl2溶液与铁粉反应:3Cu2++2Fe===3Cu+2Fe3+
D. MgCl2溶液与氨水反应:Mg2++2NH3·H2O===Mg(OH)2↓+2NH![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电致变色玻璃以其优异的性能将成为市场的新宠,如图所示五层膜的玻璃电致变色系统,其工作原理是在外接电源下,通过在膜材料内部发生氧化还原反应,实现对器件的光透过率进行多级可逆性调节。(已知:WO3和 Li4 Fe4[Fe(CN)6]3均为无色透明,LiWO3和Fe4[Fe(CN)6]3均为蓝色)下列有关说法正确的是
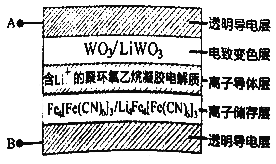
A. 当A外接电源负极时,此时Li+得到电子被还原
B. 当A外接电源正极时,膜的透射率降低,可以有效阻挡阳光
C. 当B外接电源正极时,离子导体层中Li+向下迁移
D. 当B外接电源负极时,离子储存层发生反应为:Fe4[Fe(CN)6]3+4Li++4e-=Li4Fea[Fe(CN)6]3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠( NaClO2)是一种高效氧化剂、漂白剂,主要用于棉纺、亚麻、纸浆漂白、水处理、杀菌灭藻、鱼药制造等行业。工业上可采用过氧化氢法,即在碱性条件下,用H2O2还原ClO2制备 NaClO2。某兴趣小组模拟工业生产流程在实验室中制备NaClO2,实验装置如图1所示。回答下列问题:
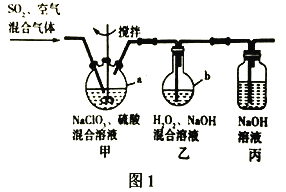
已知:纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
①检査装置气密性;②称取10.65 g NaClO3加入200mL稀硫酸中,溶解,然后转移到仪器a中;③量取适量H2O2加入100 mL NaOH浓溶液中,摇匀后转移到仪器b中;④连接好装置进行实验。
(1)装置甲中空气并不参与反应,则装置甲中发生反应的离子方程式是___________。
(2)进行实验时,需要对装置甲进行水浴加热,水浴加热的优点是________________。
(3)装置丙的作用是_______________________________________________________。
(4)装置乙中制取 NaClO2的离子方程式_________________________________。
(5)仪器b中的溶质浓度对产品含量起到关键作用,溶质浓度对产品含量的影响如图2和图3所示。结合两图信息,此时混合液中n(H2O2)/n(NaOH)=___________时为最佳,且H2O2的浓度为___________mol·L-1,其可能原因是_________________________________。
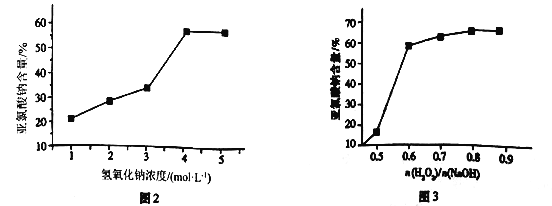
(6)实验结束后,在适当的条件下处理b中的混合液,得到产品NaClO2·3H2O 9.39g。该实验的产率为___________。(保留3位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PCl3和PCl5都是重要的化工原料.将PCl3(g)和Cl2(g)充入体积不变的2L密闭容器中,在一定条件下发生下述反应,并于10min时达到平衡:PCl3(g)+Cl2(g)![]() PCl5(g) △H<0,有关数据如下:
PCl5(g) △H<0,有关数据如下:
PCl3(g) | Cl2(g) | PCl5(g) | |
初始浓度(mol/L) | 2.0 | 1.0 | 0 |
平衡浓度(mol/L) | c1 | c2 | 0.4 |
下列判断不正确的是
A. 10 min内,v(Cl2)=0.04 mol/(Lmin)
B. 当容器中Cl2为1.2 mol时,反应达到平衡
C. 升高温度,反应的平衡常数增大,平衡时PCl3的物质的量浓度<1.6mol/L
D. 平衡后移走2.0 mol PCl3和1.0 molCl2,在相同条件下再达平衡时,c(PCl5)<0.2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是黄绿色有强烈刺激性气味的剧毒气体,是重要的工业原料。回答下列问题:
(1)将钠切去氧化层并用滤纸吸干煤油,在石棉网上微热至熔化后,立即用盛满氯气的集气瓶倒扣在其上方。现象是____________,该反应中反应物的能量______________(填“高于”或“低于”)生成物的能量。
(2)向盛有KI溶液的试管中加入少许CCl4后滴加新制的氯水,振荡后静置,CCl4层变成紫红色,用离子方程式解释:____________________________________________________。
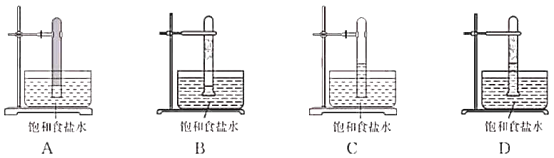
(3)光照下Cl2可与CH4反应。写出生成一氯甲烷的化学方程式:___________________。实验室中用如图所示的装置进行甲烷与氯气在光照下反应的实验。

光照下反应一段时间后,下列装置示意图中能正确反映实验现象的是_________(填标号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了测定黄铜(铜、锌合金)中铜的质量分数,取20g黄铜样品加入大烧杯中,把200g稀盐酸分四次加入,实验所得数据如下表:
实验次数 | 第一次 | 第二次 | 第三次 | 第四次 |
加入稀盐酸质量/g | 50 | 50 | 50 | 50 |
剩余固体的质量/g | 16.75 | 13.5 | m | 12.2 |
计算:
(1)表中m=______。
(2)黄铜样品中铜的质量分数为多少?(写出计算过程)______
(3)反应总共产生气体的物质的量是多少?(写出计算过程)_______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com