
 (1)A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.
(1)A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸. ,故答案为:
,故答案为: .
.


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:
 由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲和乙用导线连接插入稀盐酸溶液中,乙溶解,甲上有H2气放出 |
| B、在氧化还原反应中,甲比乙失去的电子多 |
| C、将甲乙作电极组成原电池时甲做负极 |
| D、将甲乙作电极组成电解池时甲做正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、工业上电解饱和食盐水的阳极反应:2Cl--2e-=Cl2↑ |
| B、船底镶嵌锌块,锌作负极,以防船体被腐蚀 |
| C、钢铁吸氧腐蚀的正极反应:O2+2H2O+4e-=4OH- |
| D、电解池中的阳极和原电池中的负极上都发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| A、C是还原剂,发生还原反应 |
| B、SiO2是氧化剂,在反应中被还原 |
| C、氧化还原反应的实质是电子的转移 |
| D、氧化还原反应中电子转移的总数与化合价升降总数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、M>N>P>Z |
| B、M>N>Z>P |
| C、Z>P>M>N |
| D、P>M>N>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③⑤⑦⑧ | B、②④⑦ |
| C、①⑥ | D、②④⑥⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:
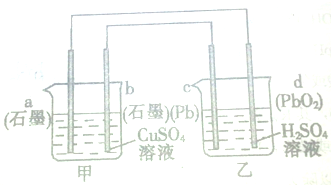
| A、电极b为阳极 |
| B、电极a上发生的反应为Cu2++2e-═Cu |
| C、工作时,装置甲中溶液的pH减小 |
| D、外电路中电子流动方向为由b经导线到c |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com