
【题目】按要求完成下列填空。
(1)在等体积的NaCl、MgCl2、AlCl3三种溶液中,分别加入等量的AgNO3溶液,恰好都完全反应,则以上三种溶液的物质的量浓度之比为______。
(2)将3.22 g芒硝(Na2SO4·10H2O)溶于水中,要使每100个水分子中溶有1个Na+,则需水的质量为________g。
(3)在干燥烧瓶中用向下排空气法收集氨气,由于空气不可能排净,所以瓶内气体对氢气的相对密度为9.5,将此瓶气体倒置于水槽中,烧瓶内液面上升的体积占烧瓶总体积的_______。
(4)100 mL 0.3 mol/L Na2SO4(密度为d1 g/cm3)和50 mL 0.2 mol/L Al2(SO4)3(密度为d2 g/cm3)混合,所得密度为d3 g/cm3的混合溶液中SO42的浓度为___________。(用含d1,d2, d3的式子表示)
(5)已知两种碱AOH和BOH的摩尔质量之比为5:7,现将7 mol AOH与5 mol BOH混合后,从中取出5.6 g,恰好可以中和100ml浓度为1.2 mol/L的盐酸,则AOH的摩尔质量为_____。
【答案】6:3:2 34.2 ![]() (或83.3%)
(或83.3%) ![]() 40g/mol
40g/mol
【解析】
(1)分别加入等量的AgNO3溶液恰好都完全反应可知,溶液中Cl﹣的物质的量相等;
(2)每100个水分子中溶有1个钠离子说明水和钠离子的物质的量比为100:1;
(3)将盛有氨气的烧瓶气体倒置于水槽中,溶液上升体积等于氨气的体积;
(4)溶质物质的量和质量、溶液的质量具有加合性,溶液的体积不具有加合性;
(5)由混合碱5.6 g恰好可以中和100mL浓度为1.2 mol/L的盐酸可知,混合碱的物质的量与盐酸的物质的量相等。
(1)设NaC1、MgCl2、A1Cl3的物质的量分别为x、y、z,由分别加入等量的AgNO3溶液恰好都完全反应可知,溶液中Cl﹣的物质的量相等,则有x=2y=3z,解得x:y:z=6:3:2,因溶液的体积相同,由物质的量之比等于浓度之比可得浓度之比为6:3:2,故答案为:6:3:2;
(2)3.22g芒硝的物质的量为![]() =1mol,溶液中n(Na+)=2n(Na2SO410H2O)=0.01mol×2=0.02mol,每100个水分子中溶有1个钠离子,所以n(H2O)=100n(Na+)=2mol,0.01molNa2SO410H2O中含有水的物质的量为0.01mol×10=0.1mol,需要的水的物质的量为2mol-0.1mol=1.9mol,则需要水的质量为1.9mol×18g/mol=34.2g,故答案为:34.2;
=1mol,溶液中n(Na+)=2n(Na2SO410H2O)=0.01mol×2=0.02mol,每100个水分子中溶有1个钠离子,所以n(H2O)=100n(Na+)=2mol,0.01molNa2SO410H2O中含有水的物质的量为0.01mol×10=0.1mol,需要的水的物质的量为2mol-0.1mol=1.9mol,则需要水的质量为1.9mol×18g/mol=34.2g,故答案为:34.2;
(3)由瓶内气体对氢气的相对密度为9.5可知,混合气体的平均摩尔质量为2g/mol×9.5=19g/mol,设氨气的体积分数为x,则空气的体积分数为(1-x),故17x+29(1-x)=19,解得x=![]() ,溶液上升体积等于氨气的体积,故烧瓶内液面上升的体积占烧瓶总体积的
,溶液上升体积等于氨气的体积,故烧瓶内液面上升的体积占烧瓶总体积的![]() ,故答案为:
,故答案为:![]() ;
;
(4)100mL0.3mol/LNa2SO4溶液中SO42-的物质的量为0.1L×0.3mol/L=0.03moL, 50mL0.2mol/LAl2(SO4)3溶液中SO42-的物质的量为0.05L×0.2moL/L×3=0.03mol,混合后的总SO42-的物质的量为0.03moL+0.03moL=0.06mol,混合溶液的体积为![]() ×10—3L,则混合溶液中SO42的浓度为
×10—3L,则混合溶液中SO42的浓度为![]() =
=![]() mol/L,故答案为:
mol/L,故答案为:![]() ;
;
(5)由混合碱5.6 g恰好可以中和100mL浓度为1.2 mol/L的盐酸可知,混合碱的物质的量与盐酸的物质的量相等,盐酸的物质的量为1.2 mol/L×0.1L=0.12mol,设5.6 g 混合碱中AOH的物质的量为7a,则BOH的物质的量为5a,由混合碱的物质的量与盐酸的物质的量相等可得7a+5a=0.12mol,解得a=0.01mol,设AOH的摩尔质量为5b,则BOH的摩尔质量为7b,由混合碱的质量为5.6g可得:0.07mol×5b+0.05mol×7b=5.6,解得b=8,则AOH的摩尔质量为40g/mol,故答案为:40g/mol。


 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:
【题目】丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。回答下列问题:
(1)正丁烷(C4H10)脱氢制1-丁烯(C4H8)的热化学方程式如下:
①C4H10(g)= C4H8(g)+H2(g) ΔH1
已知:②C4H10(g)+ ![]() O2(g)= C4H8(g)+H2O(g) ΔH2=-119 kJ·mol-1
O2(g)= C4H8(g)+H2O(g) ΔH2=-119 kJ·mol-1
③H2(g)+ ![]() O2(g)= H2O(g) ΔH3=-242 kJ·mol-1
O2(g)= H2O(g) ΔH3=-242 kJ·mol-1
反应①的ΔH1为________ kJ·mol-1。图(a)是反应①平衡转化率与反应温度及压强的关系图,x_____________0.1(填“大于”或“小于”);欲使丁烯的平衡产率提高,应采取的措施是__________(填标号)。
A.升高温度 B.降低温度 C.增大压强 D.降低压强

(2)丁烷和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出口气中含有丁烯、丁烷、氢气等。图(b)为丁烯产率与进料气中n(氢气)/n(丁烷)的关系。图中曲线呈现先升高后降低的变化趋势,其降低的原因是___________。
(3)图(c)为反应产率和反应温度的关系曲线,副产物主要是高温裂解生成的短碳链烃类化合物。丁烯产率在590℃之前随温度升高而增大的原因可能是___________、____________;590℃之后,丁烯产率快速降低的主要原因可能是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由硝酸锰[Mn(NO3)2]制备的一种含锰催化剂,常温下能去除甲醛、氢氰酸(HCN)等有毒气体。
(1) Mn2+基态核外电子排布式是________________。NO3-的空间构型为__________________(用文字描述)
(2) 甲醛分子中,碳原子的杂化方式为________。
(3) HCN分子中σ键与π键的数目比为________。H、C、N三种元素的电负性由大到小的顺序为________。
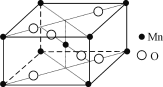
(4) 硝酸锰受热可分解生成NO2和某种锰的氧化物。该氧化物晶胞结构如右图所示。写出硝酸锰受热分解的化学方程式:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对反应:![]()
(1)配平上述化学方程式并标出该反应中电子转移情况_____________________________
(2)该反应中的氧化剂是__________ ,被氧化的元素是_____________。
(3)1 mol Cl2参加反应,被氧化的NH3 的物质的量是_____________mol。
(4)若有68g NH3参加反应,电子转移的物质的量是_______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是

A. 通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B. 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C. 负极反应为2H2O–4e–=O2+4H+,负极区溶液pH降低
D. 当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 氯化铁腐蚀铜板:Fe3++Cu===Fe2++Cu2+
B. 实验室制氯气:MnO2+4HCl(浓)![]() Mn2++2Cl2↑+2H2O
Mn2++2Cl2↑+2H2O
C. 稀硫酸中加氢氧化钡溶液至溶液呈中性:Ba2++H++OH-+SO![]() ===BaSO4↓+H2O
===BaSO4↓+H2O
D. 用氢氧化钠溶液吸收少量二氧化硫:2OH-+SO2 ===SO![]() +H2O
+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硫酸工业的 SO2 尾气、氨水、石灰石、焦炭等为原料,可以得到有重要应用价值的 CaS、(NH4)2SO3等物质,流程如下:
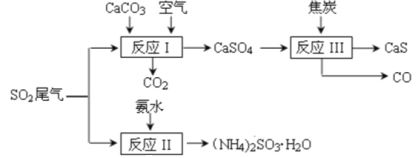
下列说法不正确的是
A. 反应Ⅰ的化学方程式为:2CaCO3+2SO2+O2=2CaSO4+2CO2
B. 生产中反应Ⅰ中需鼓入足量的空气以保证 SO2 充分氧化生成 CaSO4;向反应Ⅱ溶液中加入适量还原性很强的物质,其目的是防止(NH4)2SO3被氧化
C. 反应Ⅲ中氧化剂与还原剂的物质的量之比为1:4
D. 将反应Ⅱ后的溶液加热到有较多固体析出,再用余热将液体蒸干,可得(NH4)2SO3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. NaHCO3溶液与盐酸反应:CO32-+2H+=CO2↑+H2O
B. Fe2 (SO4) 3溶液和H2S反反应的离子方程式:2Fe3++H2S=FeS+2H+
C. NaHSO4溶液中滴加Ba(OH)2溶液至中性:2H++SO42-+2OH-+Ba2+=BaSO4↓+2H2O
D. 往NH4HCO3溶液中加过量的NaOH溶液并加热:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海藻中含有丰富的碘元素。如图是实验室从海藻里提取碘的流程的一部分。下列判断正确的是

A. 步骤④的操作是过滤
B. 可用淀粉溶液检验步骤②的反应是否进行完全
C. 步骤①、③的操作分别是过滤、萃取
D. 步骤③中加入的有机溶剂可能是酒精或四氯化碳
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com