
【题目】下列事实不能用勒夏特列原理解释的是( )
①溴水中有下列平衡Br2+H2O![]() HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
②工业合成氨反应N2(g) +3H2(g)![]() 2NH3(g) △H<0,为提高氨的产率,实际生产中采取高温、高压的措施
2NH3(g) △H<0,为提高氨的产率,实际生产中采取高温、高压的措施
③反应2 NO2(g) ![]() N2O4(g)达平衡后,缩小容器体积可使体系颜色先变深后变浅
N2O4(g)达平衡后,缩小容器体积可使体系颜色先变深后变浅
④对于2HI(g) ![]() H2(g) +I2(g),达平衡后,缩小容器体积可使体系颜色变深
H2(g) +I2(g),达平衡后,缩小容器体积可使体系颜色变深
A. ①② B. ②③ C. ③④ D. ②④
【答案】D
【解析】
①溴水中有下列平衡 Br2+H2O HBr+HBrO ,当加入硝酸银溶液后,生成溴化银沉淀,平衡向正反应方向移动;②合成氨反应,N2(g)+3H2(g) 2NH3(g) △H<0 ,降低温度有利于平衡向正反应方向移动,而高温是从加快反应速率考虑,③反应 2NO2(g)N2O4(g) 达平衡后,缩小容器体积瞬间二氧化氮气体浓度变大,可使体系颜色先变深,后平衡正向移动颜色变浅;④对于 2HI(g)H2(g)+I2(g) 气体两边的计量数相等,缩小容器体积平衡不移动;
①溴水中有下列平衡 Br2+H2O HBr+HBrO ,当加入硝酸银溶液后,生成溴化银沉淀,平衡向正反应方向移动,溶液颜色变浅,故①能用勒夏特列原理解释;②合成氨反应,N2(g)+3H2(g) 2NH3(g) △H<0 ,为提高氨的产率,理论上应采取降低温度的措施,有利于平衡向正反应方向移动,而高温是从加快反应速率考虑,故②不能用勒夏特列原理解释;③反应 2NO2(g)N2O4(g) 达平衡后,缩小容器体积瞬间二氧化氮气体浓度变大,可使体系颜色先变深,后平衡正向移动颜色变浅,故③能用勒夏特列原理解释;④对于 2HI(g)H2(g)+I2(g) 气体两边的计量数相等,缩小容器体积平衡不移动,但气体浓度变大可使体系颜色变深,故④不能用勒夏特列原理解释。综上,本题选D。


科目:高中化学 来源: 题型:
【题目】短周期主族元素R、X、Y、Z的原子序数依次增大,R的最简单气态氢化物分子的空间结构为正四面体,X的+1价阳离子的电子层结构与氖原子相同。元素X和Z形成化合物G,G中X和Z元素的质量之比为23︰16,有两种含Y元素的可溶性化合物E和F,在10mL1.0mol·L-1E溶液中滴加1.0mol·L-1F溶液,产生沉淀的物质的量(n)与F溶液体积(V)的关系如图所示。下列说法一定正确的是

A. 原子半径:X>Y>R
B. 最高价氧化物对应水化物的酸性:Z>Y>R
C. X和Y的单质组成的混合物不能完全溶于水
D. 工业上,通过电解熔融氯化物制备Y的单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用某种粗盐进行提纯实验,步骤如图所示。

请回答下列问题:
(1)步骤①和②的操作名称是_______________。
(2)进行蒸发操作时,所需仪器除带铁圈的铁架台外,还需用到蒸发皿、________和________(不考虑顺序)。当蒸发皿中有较多量固体出现时,应________,用余热使水分蒸干。
(3)猜想和验证:
猜想 | 验证方法 | 现象 | 结论 |
猜想Ⅰ:固体A中含碳酸盐 | 取少量固体A于试管中,滴加稀盐酸,并用内壁涂有澄清石灰水的小烧杯罩住试管口 | ___________ | 猜想Ⅰ成立 |
猜想Ⅱ:固体A中含BaCO3 | 取少量固体A于试管中,先滴加________,再滴加Na2SO4溶液 | 有气泡冒出,无白色沉淀 | 猜想II成立 |
猜想Ⅲ:最后制得的NaCl晶体中还含有Na2SO4 | 取少量NaCl晶体于试管中溶解,__________ | _________ | 猜想Ⅲ成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与金属腐蚀有关的说法,正确的是
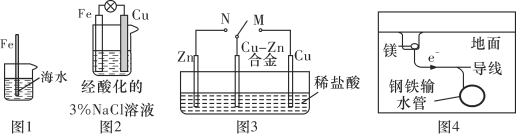
A. 图1中,插入海水中的铁棒,越靠近底端腐蚀越严重
B. 图2中,往烧杯中滴加几滴KSCN溶液,溶液变血红色
C. 图3中,开关由M改置于N时,Cu-Zn合金的腐蚀速率增大
D. 图4中,采用了牺牲阳极的阴极保护法来防止地下钢铁管道的腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积一定的密闭容器中,反应2A![]() B(g) +C(g)达到平衡后,升高温度容器内气体的密度增大,则下列叙述正确的是( )
B(g) +C(g)达到平衡后,升高温度容器内气体的密度增大,则下列叙述正确的是( )
A. 正反应是吸热反应,且A不是气态
B. 正反应是放热反应,且A是气态
C. 其他条件不变,加入少量A,该平衡向正反应方向移动
D. 改变压强对该平衡的移动无影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国炼丹家约在唐代或五代时期掌握了以炉甘石点化鑰石(即石金)的技艺:将炉甘石(ZnCO3)、赤铜矿(主要成分Cu2O和木炭粉混合加热至800℃左右可制得与黄金相似的输石金。回答下列问题:
(1)锌元素基态原子的价电子排布式为___________,铜元素基态原子中的未成对电子数为___________。
(2)硫酸锌溶于过量氨水形成[Zn(NH3)]SO4溶液。
①[Zn(NH3)4]SO4中,阴离子的立体构型是___________, [Zn(NH3)4]2+中含有的化学键有_______。
②NH3分子中,中心原子的轨道杂化类型为___________, NH3在H2O中的溶解度___________(填“大”或“小”),原因是_________________________________。
(3)铜的第一电离能为I1(Cu)=745.5 kJ·mol-1,第二电离能为l2(Cu)=1957.9 kJ·mol-1,锌的第一电离能为I1(Zn)=906.4 kJ·mol-1,第二电离能为I2(Zn)=1733.3kJ·mo1-1,I2(Cu)>I2(Zn)的原因是_______________

(4)Cu2O晶体的晶胞结构如图所示。O2-的配位数为___________;若Cu2O的密度为dg·cm-3,则晶胞参数a=___________nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化锂(LiH)在干燥的空气中能稳定存在,遇水或酸能够引起燃烧。某活动小组准备使用下列装置制备LiH固体。
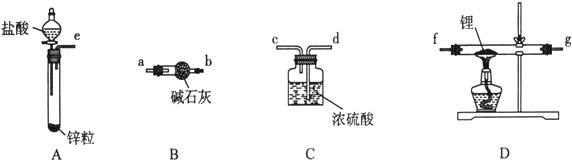
甲同学的实验方案如下:
(1)仪器的组装连接:上述仪器装置按气流从左到右连接顺序为________________,加入药品前首先要进行的实验操作是____________(不必写出具体的操作方法);其中装置B的作用是___________。
(2)添加药品:用镊子从试剂瓶中取出一定量金属锂(固体石蜡密封),然后在甲苯中浸洗数次,该操作的目的是____________________,然后快速把锂放入到石英管中。
(3)通入一段时间氢气后加热石英管,通氢气的作用是___________________________;在加热D处的石英管之前,必须进行的实验操作是__________。
(4)加热一段时间后,停止加热,继续通氢气冷却,然后取出LiH,装入氮封的瓶里,保存于暗处。采取上述操作的目的是为了避免LiH与空气中的水蒸气接触而发生危险,反应方程式为_____________。
(5)准确称量制得的产品0.174g,在一定条件下与足量水反应后,共收集到气体470.4 mL(已换算成标准状况),则产品中LiH与Li的物质的量之比为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,水的离子积常数 Kw = 1×10-13,将此温度下 pH = 11 的 Ba(OH)2溶液 a L 与 pH =1的 H2SO4 溶液 b L 混合(设混合溶液体积为两者之和,固体体积忽略不计)。下列说法不正确的是
A. 若 a∶b = 9∶2,则所得溶液 pH 等于 2
B. 若 a∶b = 9∶2,该混合溶液最多能溶解铁粉 0.28(a + b) g
C. 若所得混合溶液为中性,则 a∶b = 1∶1
D. 若所得混合溶液为中性,生成沉淀的物质的量为 0.05b mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com