
【题目】下列与金属腐蚀有关的说法,正确的是
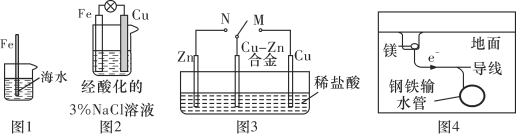
A. 图1中,插入海水中的铁棒,越靠近底端腐蚀越严重
B. 图2中,往烧杯中滴加几滴KSCN溶液,溶液变血红色
C. 图3中,开关由M改置于N时,Cu-Zn合金的腐蚀速率增大
D. 图4中,采用了牺牲阳极的阴极保护法来防止地下钢铁管道的腐蚀
科目:高中化学 来源: 题型:
【题目】有机物A~M有如图所示转化关系,A与F分子中所含碳原子数相同,且均能与NaHCO3溶液反应,F的分子式为C9H10O2,且不能使溴的CCl4溶液褪色,D能发生银镜反应,M与NaOH溶液反应后的产物,其一氯代物只有一种。

已知: (R1、R2表烃基或氢原子)
(R1、R2表烃基或氢原子)
请回答:
(1)B、F的结构简式分别为________、________。
(2)反应①~⑦中,属于消去反应的是________(填反应序号)。
(3)D发生银镜反应的化学方程式为______________________________;反应⑦的化学方程式为______________________________。
(4)A的相对分子质量在180~260之间,从以上转化中不能确认A中的某一官能团,确定该官能团的实验步骤和现象为__________________________________________。
(5)符合下列条件的F的同分异构体共有________种。
a.能发生银镜反
b.能与FeCl3溶液发生显色反应
c.核磁共振氢谱上有四个峰,其峰面积之比为1∶1∶2∶6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组按如下实验流程探究海带中碘含量的测定和碘的制取。
实验(一) 碘含量的测定

实验(二) 碘的制取
另制海带浸取原液,甲、乙两种实验方案如下:
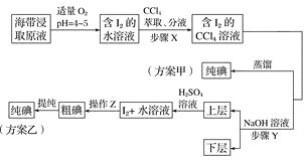
已知:3I2+6NaOH===5NaI+NaIO3+3H2O。
(1)实验(一) 中的仪器名称:仪器A________, 仪器 B________。
(2)①分液漏斗使用前须检漏,检漏方法为__________________。
②步骤X中,萃取后分液漏斗内观察到的现象是___________________。
③下列有关步骤Y的说法,正确的是________。
A 应控制NaOH溶液的浓度和体积
B 将碘转化成离子进入水层
C 主要是除去海带浸取原液中的有机杂质
D NaOH溶液可以由乙醇代替
④实验(二) 中操作Z的名称是________。
(3)方案甲中采用蒸馏不合理,理由是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、环境密切相关,下列说法不正确的是
A.竹炭具有超强的吸附能力,可用于吸收新装修房屋内的有害气体
B.溴化银见光易分解,可用于制作感光材料
C.碘酸钾具有较强氧化性,在食盐中加入适量碘酸钾,可抗人体衰老
D.Na2O2吸收CO2产生O2,可用作呼吸面具中的供氧剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是( )
①溴水中有下列平衡Br2+H2O![]() HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
②工业合成氨反应N2(g) +3H2(g)![]() 2NH3(g) △H<0,为提高氨的产率,实际生产中采取高温、高压的措施
2NH3(g) △H<0,为提高氨的产率,实际生产中采取高温、高压的措施
③反应2 NO2(g) ![]() N2O4(g)达平衡后,缩小容器体积可使体系颜色先变深后变浅
N2O4(g)达平衡后,缩小容器体积可使体系颜色先变深后变浅
④对于2HI(g) ![]() H2(g) +I2(g),达平衡后,缩小容器体积可使体系颜色变深
H2(g) +I2(g),达平衡后,缩小容器体积可使体系颜色变深
A. ①② B. ②③ C. ③④ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组化学用语中:①3He、4He ② 2H2 O、1H2O ③ 1H、3H ④14N和13C质子数相同的有_________,中子数相同的有________,互为同位素的有________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)取20 mL pH=3的CH3COOH溶液,加入0.2 mol·L-1的氨水,测得溶液导电性变化如图,则加入氨水前CH3COOH的电离度(分子电离的百分数)为______________,加入0~10 mL的氨水导电能力增强的原因_________________________。

(2)将醋酸铵固体溶于水,配成0.1 mol·L-1溶液,已知醋酸的电离平衡常数为Ka,一水合氨的电离平衡常数为Kb,实验发现两者近似相等,请写出醋酸铵水解的离子方程式______________________,水解平衡常数的表达式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物G是一种高分子化合物,常用作有机合成的中间体,并可用作乳胶漆等。可以通过以下途径合成:

已知有机物A中含有C、H、O、Cl四种元素且同一个碳原子上不直接连接两个官能团。
(1)A的结构简式为___________或___________;反应③的反应类型_____________________。
(2) 写出反应⑤和反应⑥的化学方程式:反应⑤___________;反应⑥(在一定条件下)___________。
(3)写出1种E的同系物的名称_____________________。写出1种与F含有相同官能团的F的同分异构体的结构简式_______________。
(4)试设计一条以![]() 为原料合成
为原料合成![]() 的合成路线__________________。(合成路线常用的表示方式为:甲
的合成路线__________________。(合成路线常用的表示方式为:甲![]() 乙……
乙……![]() 目标产物)
目标产物)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com