
【题目】下列各组化学用语中:①3He、4He ② 2H2 O、1H2O ③ 1H、3H ④14N和13C质子数相同的有_________,中子数相同的有________,互为同位素的有________。
 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
【题目】三个密闭容器中分别充入N2、H2、O2三种气体,以下各种情况下排序正确的是( )
A. 当它们的温度和压强均相同时,三种气体的密度:ρ(H2)>ρ(N2)>ρ(O2)
B. 当它们的温度和密度都相同时,三种气体的压强:p(H2)>p(N2)>p(O2)
C. 当它们的质量和温度、压强均相同时,三种气体的体积:V(O2)>V(N2)>V(H2)
D. 当它们的压强和体积、温度均相同时,三种气体的质量:m(H2)>m(N2)>m(O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物W(![]() )、M(
)、M(![]() )、N(
)、N(![]() )的分子式均为C7H8。下列说法正确的是
)的分子式均为C7H8。下列说法正确的是
A. W、M、N均能与溴水发生加成反应
B. W、M、N的一氯代物数目相等
C. W、M、N分子中的碳原子均共面
D. W、M、N均能使酸性KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与金属腐蚀有关的说法,正确的是
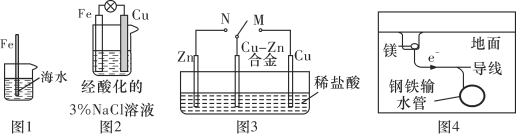
A. 图1中,插入海水中的铁棒,越靠近底端腐蚀越严重
B. 图2中,往烧杯中滴加几滴KSCN溶液,溶液变血红色
C. 图3中,开关由M改置于N时,Cu-Zn合金的腐蚀速率增大
D. 图4中,采用了牺牲阳极的阴极保护法来防止地下钢铁管道的腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子能在溶液中大量共存的是
A.Ca2+、Na+、NO3-、ClO-B.NH4+、Na+、HCO3-、OH-
C.H+、K+、MnO4-、S2-D.Mg2+、K+、Cl-、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国炼丹家约在唐代或五代时期掌握了以炉甘石点化鑰石(即石金)的技艺:将炉甘石(ZnCO3)、赤铜矿(主要成分Cu2O和木炭粉混合加热至800℃左右可制得与黄金相似的输石金。回答下列问题:
(1)锌元素基态原子的价电子排布式为___________,铜元素基态原子中的未成对电子数为___________。
(2)硫酸锌溶于过量氨水形成[Zn(NH3)]SO4溶液。
①[Zn(NH3)4]SO4中,阴离子的立体构型是___________, [Zn(NH3)4]2+中含有的化学键有_______。
②NH3分子中,中心原子的轨道杂化类型为___________, NH3在H2O中的溶解度___________(填“大”或“小”),原因是_________________________________。
(3)铜的第一电离能为I1(Cu)=745.5 kJ·mol-1,第二电离能为l2(Cu)=1957.9 kJ·mol-1,锌的第一电离能为I1(Zn)=906.4 kJ·mol-1,第二电离能为I2(Zn)=1733.3kJ·mo1-1,I2(Cu)>I2(Zn)的原因是_______________

(4)Cu2O晶体的晶胞结构如图所示。O2-的配位数为___________;若Cu2O的密度为dg·cm-3,则晶胞参数a=___________nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是一种廉价的碳资源,其综合利用具有重要意义。回答下列问题:
(1)CO2可以被NaOH溶液捕获。常温下,若所得溶液pH=13,CO2主要转化为________(写离子符号);若所得溶液c(HCO3-)∶c(CO32-)=2∶1,溶液pH=__________。(室温下,H2CO3的K1=4×10-7;K2=5×10-11)
(2)已知25℃,NH3·H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8。若氨水的浓度为2.0 mol·L-1,溶液中的c(OH-)=________________mol·L-1。将SO2通入该氨水中,当c(OH-)降至1.0×10-7mol·L-1时,溶液中的c(SO32-)/c(HSO3-)=__________________。
(3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl-,利用Ag+与CrO42-生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好沉淀完全(浓度等于1.0×10-5mol·L-1)时,溶液中c(Ag+)为________mol·L-1,此时溶液中c(CrO42-)等于__________mol·L-1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×10-12和2.0×10-10)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某结晶水合物的化学式为AnH2O,A的相对分子质量为M,若将ag该化合物加热至结晶水全部失去,剩余的残渣质量为bg,则n=_______
(2)某液态化合物X2Y4,常用作火箭燃料。16gX2Y4在一定量的O2中恰好完全燃烧,反应方程式X2Y4(l)+O2(g)=X2(g)+2Y2O(l))。冷却后测得生成物X2在标准状况下密度为1.25g/L。则
①X2的摩尔质量为_________
②Y2O 是最常见的液态化合物,X2Y4的化学式为__________
③反应前O2的体积(标准状况下)为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施对增大反应速率明显有效的是
A. 在K2SO4与BaCl2两溶液反应时,增大压强
B. Fe与稀硫酸反应制取H2时,改用浓硫酸
C. Al在氧气中燃烧生成A12O3,将Al片改成Al粉
D. Na与水反应时增大水的用量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com