
【题目】下列措施对增大反应速率明显有效的是
A. 在K2SO4与BaCl2两溶液反应时,增大压强
B. Fe与稀硫酸反应制取H2时,改用浓硫酸
C. Al在氧气中燃烧生成A12O3,将Al片改成Al粉
D. Na与水反应时增大水的用量
科目:高中化学 来源: 题型:
【题目】下列各组化学用语中:①3He、4He ② 2H2 O、1H2O ③ 1H、3H ④14N和13C质子数相同的有_________,中子数相同的有________,互为同位素的有________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种用软锰矿(主要成分MnO2)和黄铁矿(主要成分FeS2)制取MnSO4·H2O并回收单质硫的工艺流程如下:

回答下列问题:
(1)步骤②浸取时若生成S、MnSO4及Fe2(SO4)3的化学方程式为______________________。
(2)步骤③所得酸性滤液可能含有Fe2+,除去Fe2+可用的物质是______________________;步骤④需将溶液加热至沸然后在不断搅拌下加入碱调节pH4~5,再继续煮沸一段时间,“继续煮沸”的目的是___________。步骤⑤所得滤渣为___________(填化学式)。
(3)步骤⑦需在90~100℃下进行,该反应的化学方程式为______________________。
(4)测定产品MnSO4·H2O的方法之一是:准确称取ag产品于锥形瓶中,加入适量ZnO及H2O煮沸,然后用 c mol·L-1 KMnO4标准溶液滴定至浅红色且半分钟不褪,消耗标准溶液VmL,滴定反应的离子方程式为_________________________________,产品中Mn2+的质量分数为w(Mn2+)=_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物G是一种高分子化合物,常用作有机合成的中间体,并可用作乳胶漆等。可以通过以下途径合成:

已知有机物A中含有C、H、O、Cl四种元素且同一个碳原子上不直接连接两个官能团。
(1)A的结构简式为___________或___________;反应③的反应类型_____________________。
(2) 写出反应⑤和反应⑥的化学方程式:反应⑤___________;反应⑥(在一定条件下)___________。
(3)写出1种E的同系物的名称_____________________。写出1种与F含有相同官能团的F的同分异构体的结构简式_______________。
(4)试设计一条以![]() 为原料合成
为原料合成![]() 的合成路线__________________。(合成路线常用的表示方式为:甲
的合成路线__________________。(合成路线常用的表示方式为:甲![]() 乙……
乙……![]() 目标产物)
目标产物)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铝土矿(主要成分为Al2O3)为原料,用真空氯化亚铝(AlCl)歧化法,无需进行分离提纯,直接制备金属Al。其反应过程主要由两步组成,如下图:

(1)已知:
Al2O3 (s) + 3C (s)![]() 2Al (l) + 3CO (g) ΔH=+1346 kJ·mol 1
2Al (l) + 3CO (g) ΔH=+1346 kJ·mol 1
3AlCl (g)![]() AlCl3 (g) + 2Al (l) ΔH=140 kJ·mol 1
AlCl3 (g) + 2Al (l) ΔH=140 kJ·mol 1
①第一步反应的热化学方程式是______。
②第二步AlCl分解反应的化学平衡常数K随温度升高而______(填“增大”、“不
变”或“减小”)。
(2)第一步是可逆反应,选择在接近真空条件下进行,其原因是______。
(3)第二步反应制备的Al中含有少量C,可能的原因是______(不考虑未反应的C,写出1种即可)。
(4)如图为真空AlCl歧化法制备Al的实验装置示意图,控制AlCl3的凝华装置、Al的生成装置和AlCl的制备装置的温度分别为T1、T2、T3,其由高到低的顺序是______。

(5)制备Al的整个过程中可循环利用的物质是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇作为基本的有机化工产品和环保动力燃料具有广阔的应用前景,CO2 加氢合成甲醇是合理利用 CO2 的有效途径。由 CO2 制备甲醇过程可能涉及反应如下:
反应Ⅰ:CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH1=+41.19 kJ·mol-1
CO(g)+H2O(g) ΔH1=+41.19 kJ·mol-1
反应Ⅱ:CO(g)+2H2(g)![]() CH3OH(g) ΔH2
CH3OH(g) ΔH2
反应Ⅲ:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH3=-49.58 kJ·mol-1
CH3OH(g)+H2O(g) ΔH3=-49.58 kJ·mol-1
回答下列问题:
(1)反应Ⅲ的 ΔS_____(填“<”、“=”或“>”)0;反应Ⅱ的 ΔH2=_____。

(2)在恒压密闭容器中,充入一定量的 H2 和 CO2(假定仅发生反应Ⅲ),实验测得反应物在不同温度下,反应体系中 CO2 的平衡转化率与压强的关系曲线如图所示。
①比较T1与T2 的大小关系:T1_____T2 (填“ < ”、“= ”或“> ”) ,理由是:_____。
②在 T1 和 p6 的条件下,往密闭容器中充入 3 mol H2 和 1 mol CO2,该反应在第 5 min 时达到平衡,此时容器的体积为 1.8 L,则该反应在此温度下的平衡常数为_____。
a.若此条件下反应至 3 min 时刻,改变条件并于 A 点处达到平衡,CH3OH 的浓度随反应时间的变化趋势如图所示(3~4 min 的浓度变化未表示出来),则改变的条件为_____,请用 H2 的浓度变化计算从4 min 开始到A点的反应速率v(H2)=_____(保留两位小数)。
b.若温度不变,压强恒定在 p8 的条件下重新达到平衡时,容器的体积变为_____L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学教师为 “氯气与金属钠反应”设计了如图装置的实验。实验操作:先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟。以下叙述中错误的是( )

A. 反应生成的大量白烟是氯化钠晶体
B. 玻璃管尾部塞一团浸有NaOH溶液的棉球是用于吸收过量的氯气,以免其污染空气
C. 钠着火燃烧产生苍白色火焰
D. 发生的反应为2Na+Cl2![]() 2NaCl
2NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2CO3(aq)与盐酸反应过程中的能量变化示意图如下,下列选项正确的是
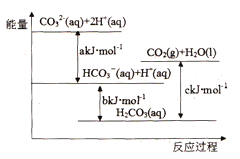
A. H2CO3(aq)=CO2(g)+H2O(l)为放热反应
B. CO32-(aq)+ H+(aq)=HCO3-(aq) △H=akJ/mol
C. HCO3-(aq)+H+(aq)= CO2(g)+H2O(l) △H=(c-b)kJ/mol
D. CO32-(aq)+ 2H+(aq)= CO2(g)+H2O(l) △H=(a+b-c)kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I “碘钟”实验中,3I-+S2O82-===I3—+2SO42-的反应速率可以用![]() 遇加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20 ℃进行实验,得到的数据如下表:
遇加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20 ℃进行实验,得到的数据如下表:
实验编号 | ① | ② | ③ | ④ | ⑤ |
c(I-)/mol/L | 0.040 | 0.080 | 0.080 | 0.160 | 0.120 |
c(S2O82-)/mol/L | 0.040 | 0.040 | 0.080 | 0.020 | 0.040 |
t/s | 88.0 | 44.0 | 22.0 | 44.0 | t1 |
回答下列问题:
(1)该实验的目的是____________________________________________________________。
(2)显色时间t1为________。
(3)通过分析比较上述数据,得到的结论是___________________________________________________。
II根据反应4FeS2+11O2===2Fe2O3+8SO2,试回答下列问题。
(1)通常选用哪些物质来表示该反应的化学反应速率____________。
(2)当生成SO2的速率为0.64 mol·L-1·s-1时,则氧气减少的速率为________。
(3)如测得4 s后O2的浓度为2.8 mol·L-1,此时间内SO2的速率为0.4 mol·L-1·s-1,则开始时氧气的浓度为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com