
【题目】甲醇作为基本的有机化工产品和环保动力燃料具有广阔的应用前景,CO2 加氢合成甲醇是合理利用 CO2 的有效途径。由 CO2 制备甲醇过程可能涉及反应如下:
反应Ⅰ:CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH1=+41.19 kJ·mol-1
CO(g)+H2O(g) ΔH1=+41.19 kJ·mol-1
反应Ⅱ:CO(g)+2H2(g)![]() CH3OH(g) ΔH2
CH3OH(g) ΔH2
反应Ⅲ:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH3=-49.58 kJ·mol-1
CH3OH(g)+H2O(g) ΔH3=-49.58 kJ·mol-1
回答下列问题:
(1)反应Ⅲ的 ΔS_____(填“<”、“=”或“>”)0;反应Ⅱ的 ΔH2=_____。

(2)在恒压密闭容器中,充入一定量的 H2 和 CO2(假定仅发生反应Ⅲ),实验测得反应物在不同温度下,反应体系中 CO2 的平衡转化率与压强的关系曲线如图所示。
①比较T1与T2 的大小关系:T1_____T2 (填“ < ”、“= ”或“> ”) ,理由是:_____。
②在 T1 和 p6 的条件下,往密闭容器中充入 3 mol H2 和 1 mol CO2,该反应在第 5 min 时达到平衡,此时容器的体积为 1.8 L,则该反应在此温度下的平衡常数为_____。
a.若此条件下反应至 3 min 时刻,改变条件并于 A 点处达到平衡,CH3OH 的浓度随反应时间的变化趋势如图所示(3~4 min 的浓度变化未表示出来),则改变的条件为_____,请用 H2 的浓度变化计算从4 min 开始到A点的反应速率v(H2)=_____(保留两位小数)。
b.若温度不变,压强恒定在 p8 的条件下重新达到平衡时,容器的体积变为_____L。
【答案】 < -90.77 kJ·mol-1 < 反应Ⅲ为放热反应,温度降低,反应正向移动,所以 T1<T2 4/27 或 0.148 降低压强 0.08 mol·L-1min-1 8/15 或 0.533
【解析】
(1)气体物质的混乱度与分子数有关,分子数越大混乱度越大,反应III正反应气体分数目减小,所以混乱度减小,熵减小ΔS<0。根据盖斯定律,因为反应II=反应III反应I,所以ΔH2=-49.58kJ/mol-41.19kJ/mol=-90.77kJ/mol。
(2) 从CO2 的平衡转化率与压强的关系曲线图上看出,当压强相同时T1曲线的转化率大于T2曲线的转化率,说明T2→T1过程平衡向正反应方向移动,而反应III正反应是放热反应,根据勒夏特列原理,降低温度平衡向放热方向移动,所以T1<T2,答案:< 反应Ⅲ为放热反应,温度降低,反应正向移动,所以 T1<T2。
②由CO2 的平衡转化率与压强的关系曲线图知,T1和P6的条件下CO2的平衡转化率为40%,
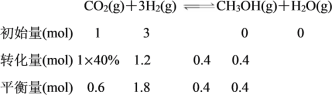
此温度下平衡常数为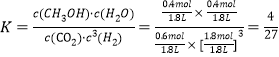 ;
;
a.由图像可知,改变条件达到平衡所用的时间大于5min,说明反应速率减慢,而且平衡时(A点)CH3OH浓度比原平衡(![]() )小,所以改变的条件只能是降低压强;由图像知第4min到A点甲醇浓度变化量Δc(CH3OH)=0.21mol/L-0.15mol/L=0.06mol/L,所以H2的变化浓度Δc(H2)=3Δc(CH3OH)=3×0.06mol/L=0.18mol/L,所以用H2表示的反应速率
)小,所以改变的条件只能是降低压强;由图像知第4min到A点甲醇浓度变化量Δc(CH3OH)=0.21mol/L-0.15mol/L=0.06mol/L,所以H2的变化浓度Δc(H2)=3Δc(CH3OH)=3×0.06mol/L=0.18mol/L,所以用H2表示的反应速率![]() ;
;
b.由图可知,T1和P8条件下CO2的转化率为60%,设此时容器容积为VL,因为温度不变平衡常数不变,K=![]() 。
。
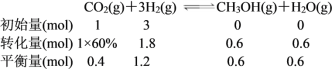
将数值代入平衡常数计算式中: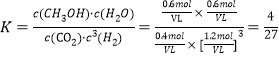 ,解得V=
,解得V=![]() 或0.533。
或0.533。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】中国炼丹家约在唐代或五代时期掌握了以炉甘石点化鑰石(即石金)的技艺:将炉甘石(ZnCO3)、赤铜矿(主要成分Cu2O和木炭粉混合加热至800℃左右可制得与黄金相似的输石金。回答下列问题:
(1)锌元素基态原子的价电子排布式为___________,铜元素基态原子中的未成对电子数为___________。
(2)硫酸锌溶于过量氨水形成[Zn(NH3)]SO4溶液。
①[Zn(NH3)4]SO4中,阴离子的立体构型是___________, [Zn(NH3)4]2+中含有的化学键有_______。
②NH3分子中,中心原子的轨道杂化类型为___________, NH3在H2O中的溶解度___________(填“大”或“小”),原因是_________________________________。
(3)铜的第一电离能为I1(Cu)=745.5 kJ·mol-1,第二电离能为l2(Cu)=1957.9 kJ·mol-1,锌的第一电离能为I1(Zn)=906.4 kJ·mol-1,第二电离能为I2(Zn)=1733.3kJ·mo1-1,I2(Cu)>I2(Zn)的原因是_______________

(4)Cu2O晶体的晶胞结构如图所示。O2-的配位数为___________;若Cu2O的密度为dg·cm-3,则晶胞参数a=___________nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,水的离子积常数 Kw = 1×10-13,将此温度下 pH = 11 的 Ba(OH)2溶液 a L 与 pH =1的 H2SO4 溶液 b L 混合(设混合溶液体积为两者之和,固体体积忽略不计)。下列说法不正确的是
A. 若 a∶b = 9∶2,则所得溶液 pH 等于 2
B. 若 a∶b = 9∶2,该混合溶液最多能溶解铁粉 0.28(a + b) g
C. 若所得混合溶液为中性,则 a∶b = 1∶1
D. 若所得混合溶液为中性,生成沉淀的物质的量为 0.05b mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施对增大反应速率明显有效的是
A. 在K2SO4与BaCl2两溶液反应时,增大压强
B. Fe与稀硫酸反应制取H2时,改用浓硫酸
C. Al在氧气中燃烧生成A12O3,将Al片改成Al粉
D. Na与水反应时增大水的用量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全世界每年因生锈损失的钢铁,约占世界年产量的十分之一。一种钢铁锈蚀原理示意图如右,下列说法不正确的是

A. 缺氧区:Fe-2e-=== Fe2+
B. 富氧区:O2 + 2H2O + 4e-=== 4OH-
C. Fe失去的电子通过电解质溶液传递给O2
D. 隔绝氧气或电解质溶液均可有效防止铁生锈
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于元素周期表的说法中正确的是( )
A. 元素周期表共7个周期、18个族B. 38号元素位于第五周期第IIA族
C. 非金属元素均位于周期表右侧D. 第六周期共计18种元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知分解1molKClO3放出热量38.8kJ,在MnO2下加热,KClO3的分解分为两步:
①2KClO3+4MnO2![]() 2KCl+2Mn2O7 慢
2KCl+2Mn2O7 慢
②2Mn2O7![]() 4MnO2+3O2 快
4MnO2+3O2 快
下列有关说法不正确的是
A. 1molKClO3所具有的总能量高于1molKCl所具有的总能量
B. 1gKClO3 ,1gMnO2,0.1gMn2O7混合加热,充分反应后MnO2质量仍为1g
C. KClO3分解速率快慢主要取决于反应①
D. 将固体二氧化锰碾碎,可加快KClO3的分解速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某市售盐酸试剂瓶标签上的部分信息如下:
盐酸
化学式:HCl
相对分子质量:36.5
密度约1.18 g·mL-1
HCl的质量分数:36.5%
(1)该盐酸中HCl的物质的量浓度=_____。
(2)取该盐酸50 mL加水稀释到100 mL,则稀释后溶液中c(HCl)=____。该实验选用的主要仪器有:烧杯、量筒、玻璃棒、和_________。
(3)该操作的正确顺序为_____(填序号)。
a.反复颠倒摇匀 b. 稀释浓盐酸c.用胶头滴管加水至刻度线 d.用量筒量取浓盐酸e.将配制好的溶液转入试剂瓶中贴上标签f.将溶液转入容量瓶
(4)下列情况对所配制的稀盐酸浓度有何影响?用“偏大”“偏小”或“无影响”填写。
a.所用的浓盐酸长时间放置在密封不好的容器中_____。
b.用量筒量取浓盐酸时,仰视刻度线_____。
c.洗涤量取过浓盐酸的量筒,并将洗液注入容量瓶中_____。
d.定容时俯视容量瓶的刻度线_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com