
【题目】某学习小组按如下实验流程探究海带中碘含量的测定和碘的制取。
实验(一) 碘含量的测定

实验(二) 碘的制取
另制海带浸取原液,甲、乙两种实验方案如下:
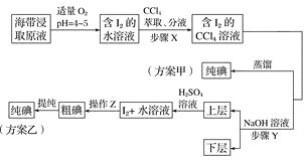
已知:3I2+6NaOH===5NaI+NaIO3+3H2O。
(1)实验(一) 中的仪器名称:仪器A________, 仪器 B________。
(2)①分液漏斗使用前须检漏,检漏方法为__________________。
②步骤X中,萃取后分液漏斗内观察到的现象是___________________。
③下列有关步骤Y的说法,正确的是________。
A 应控制NaOH溶液的浓度和体积
B 将碘转化成离子进入水层
C 主要是除去海带浸取原液中的有机杂质
D NaOH溶液可以由乙醇代替
④实验(二) 中操作Z的名称是________。
(3)方案甲中采用蒸馏不合理,理由是________________________。
【答案】坩埚 500 mL容量瓶 向分液漏斗中加入少量水,检查旋塞处是否漏水;将漏斗倒转过来,检查玻璃塞是否漏水 液体分上下两层,下层呈紫红色 AB 过滤 主要由于碘易升华,会导致碘的损失
【解析】
(1)在仪器A中灼烧海带,该仪器为坩埚;配制溶液体积为500mL,应该选用规格为500mL的容量瓶;
(2)①检查分液漏斗是否漏水,需要分别检查瓶塞、旋塞是否漏水;
②碘单质易溶于有机溶剂,且四氯化碳溶液密度大于水溶液,检查判断萃取现象;
③A.反应3I2+6NaOH=5NaI+NaIO3+3H2O中,需要浓氢氧化钠溶液;
B.碘单质与氢氧化钠反应生成了碘化钠、碘酸钠;
C.该操作的主要目的是将碘单质转化成碘酸钠、碘化钠,便于后续分离出碘单质;
D.乙醇易溶于水和四氯化碳,仍然无法分离出碘单质.
④碘单质不溶于水,可以通过过滤操作分离出碘单质;
(3)从碘单质易升华角度分析。
(1)根据仪器的构造可知,用于灼烧海带的仪器为坩埚;通过仪器B配制500mL含有碘离子的浸取液,需要使用500mL的容量瓶,故答案为:坩埚;500mL容量瓶;
(2)①分液漏斗的检漏应先检查漏斗颈旋塞处是否漏水,再检查漏斗口玻璃塞处是否漏水,其方法是:检查漏斗颈旋塞处是否漏水时,先关闭分液漏斗的旋塞,加入适量的水,看是否漏水,若不漏,再将活塞旋转180°后观察是否漏水;检查漏斗口玻璃塞处是否漏水时,先关闭分液漏斗的旋塞,加入适量的水,把漏斗倒过来观察是否漏水,若不漏,将玻璃塞旋转180度后再倒置观察,若还是不漏水,则玻璃塞处不漏水;
②步骤X为萃取操作,由于CCl4密度比水大,且I2易溶于CCl4,故萃取后分液漏斗内观察到的现象液体分为上下两层,上层呈无色,下层呈紫红色;
③据题中所给信息:3I2+6NaOH=5NaI+NaIO3+3H2O,步骤Y目的在于把碘元素全部由CCl4层转移入水层,NaOH溶液应过量,为了下一步便于提取碘,所加氢氧化钠溶液的体积不能过多,故其浓度不能太小,故选项A、B正确,选项C错误,由于I2在CCl4和酒精中都易溶解,且CCl4和酒精互溶,酒精不能从I2的CCl4溶液中萃取I2,选项D错误;
答案选AB;
④实验(二)中,由于碘单质在酸性溶液的溶解度很小,碘在水溶液中以晶体析出,故操作Z是过滤;
(3)由于碘易升华,加热碘的四氯化碳溶液时,碘易挥发,会导致碘的损失,故不采用蒸馏方法。


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
【题目】将4gNaOH固体溶于水配制成250mL溶液,此溶液中NaOH的物质的量浓度为__________。取出10mL此溶液,其中含有NaOH_________g。将取出的溶液加水稀释到100mL,稀释后溶液中NaOH的物质的量浓度为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积可变的密闭容器中存在如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH<0,下列分析中不正确的是( )
CO2(g)+H2(g) ΔH<0,下列分析中不正确的是( )

A. 图Ⅰ研究的是t0时升高温度对反应速率的影响
B. 图Ⅱ研究的是t0时增大压强(缩小容积)或使用催化剂对反应速率的影响
C. 图Ⅲ研究的是催化剂对化学平衡的影响,且甲使用了催化剂
D. 图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物W(![]() )、M(
)、M(![]() )、N(
)、N(![]() )的分子式均为C7H8。下列说法正确的是
)的分子式均为C7H8。下列说法正确的是
A. W、M、N均能与溴水发生加成反应
B. W、M、N的一氯代物数目相等
C. W、M、N分子中的碳原子均共面
D. W、M、N均能使酸性KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用某种粗盐进行提纯实验,步骤如图所示。

请回答下列问题:
(1)步骤①和②的操作名称是_______________。
(2)进行蒸发操作时,所需仪器除带铁圈的铁架台外,还需用到蒸发皿、________和________(不考虑顺序)。当蒸发皿中有较多量固体出现时,应________,用余热使水分蒸干。
(3)猜想和验证:
猜想 | 验证方法 | 现象 | 结论 |
猜想Ⅰ:固体A中含碳酸盐 | 取少量固体A于试管中,滴加稀盐酸,并用内壁涂有澄清石灰水的小烧杯罩住试管口 | ___________ | 猜想Ⅰ成立 |
猜想Ⅱ:固体A中含BaCO3 | 取少量固体A于试管中,先滴加________,再滴加Na2SO4溶液 | 有气泡冒出,无白色沉淀 | 猜想II成立 |
猜想Ⅲ:最后制得的NaCl晶体中还含有Na2SO4 | 取少量NaCl晶体于试管中溶解,__________ | _________ | 猜想Ⅲ成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与金属腐蚀有关的说法,正确的是
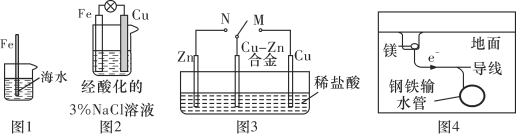
A. 图1中,插入海水中的铁棒,越靠近底端腐蚀越严重
B. 图2中,往烧杯中滴加几滴KSCN溶液,溶液变血红色
C. 图3中,开关由M改置于N时,Cu-Zn合金的腐蚀速率增大
D. 图4中,采用了牺牲阳极的阴极保护法来防止地下钢铁管道的腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国炼丹家约在唐代或五代时期掌握了以炉甘石点化鑰石(即石金)的技艺:将炉甘石(ZnCO3)、赤铜矿(主要成分Cu2O和木炭粉混合加热至800℃左右可制得与黄金相似的输石金。回答下列问题:
(1)锌元素基态原子的价电子排布式为___________,铜元素基态原子中的未成对电子数为___________。
(2)硫酸锌溶于过量氨水形成[Zn(NH3)]SO4溶液。
①[Zn(NH3)4]SO4中,阴离子的立体构型是___________, [Zn(NH3)4]2+中含有的化学键有_______。
②NH3分子中,中心原子的轨道杂化类型为___________, NH3在H2O中的溶解度___________(填“大”或“小”),原因是_________________________________。
(3)铜的第一电离能为I1(Cu)=745.5 kJ·mol-1,第二电离能为l2(Cu)=1957.9 kJ·mol-1,锌的第一电离能为I1(Zn)=906.4 kJ·mol-1,第二电离能为I2(Zn)=1733.3kJ·mo1-1,I2(Cu)>I2(Zn)的原因是_______________

(4)Cu2O晶体的晶胞结构如图所示。O2-的配位数为___________;若Cu2O的密度为dg·cm-3,则晶胞参数a=___________nm。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com