
【题目】将4gNaOH固体溶于水配制成250mL溶液,此溶液中NaOH的物质的量浓度为__________。取出10mL此溶液,其中含有NaOH_________g。将取出的溶液加水稀释到100mL,稀释后溶液中NaOH的物质的量浓度为____________。
 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:
【题目】煤是重要能源。燃煤会释放SO2、CO等有毒气体。消除有毒气体的研究和实践从未停止。完成下列填空:
I.用CaSO4消除CO。CaSO4和CO可发生如下两个反应:
反应①:CaSO4(s)+4CO(g)![]() CaS(s)+4CO2(g)+175.6kJ
CaS(s)+4CO2(g)+175.6kJ
反应②:CaSO4(s)+4CO(g)![]() CaO(s)+SO2(g)+CO2(g)—218.4kJ
CaO(s)+SO2(g)+CO2(g)—218.4kJ
(1)写出反应①的平衡常数表达式:_____________;一定条件下的密闭容器中,两反应均达平衡后,若使反应①K的减小,需要改变的反应条件是______________,则反应②的K___________(选填编号)、反应①的v(CO2)正__________(选填编号)。
a. 增大 b. 减小 c. 不变 d. 无法判断
(2)补全下图中反应②的能量变化示意图_______________(即,注明生成物能量的大致位置及反应热效应数值)

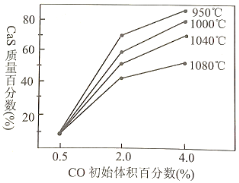
(3)下图是不同温度下,CO初始体积百分数与平衡时固体产物中CaS质量百分数的关系曲线。写出两种降低SO2生成量的措施___________________________________。
II. Fe2(SO4)3溶液可除去煤中以黄铁矿(FeS2)形式存在的硫元素,反应如下:8H2O + FeS2+ 7Fe2(SO4)3→15FeSO4+ 8H2SO4
(4)标出电子转移的数目和方向________;还原产物是_______。
(5)检验上述反应中Fe2(SO4)3是否消耗完的实验方案:___________________________。
(6)该方法的优点之一是Fe2(SO4)3易再生。向反应后的溶液中通入___________,就能达到使Fe2(SO4)3再生的目的,方便且价廉。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某电镀污泥含有碲化亚铜(Cu2Te)、三氧化二铬(Cr2O3)以及少量金等,某小组设计如下资源综合利用的方案:

已知:碲和硫位于同主族,煅烧时Cu2Te发生的反应为Cu2Te+2O2![]() 2CuO+TeO2,滤渣中TeO2溶于稀硫酸发生的反应为TeO2+H2SO4=TeOSO4+H2O。下列说法不正确的是
2CuO+TeO2,滤渣中TeO2溶于稀硫酸发生的反应为TeO2+H2SO4=TeOSO4+H2O。下列说法不正确的是
A. “高温”灼烧电镀污泥时铜碲和铬元素都被氧化
B. 酸化Na2CrO4溶液时可用浓盐酸
C. 上述流程可以回收的金属单质有金和铜
D. 滤液3可以循环利用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近一期《物理评论快报》报道了科学家成功制备了包含钙钾、铁和砷以及少量镍的CaK(Fe1-xNix)4As4新型化合物材料。
回答下列问题:
(1)基态镍原子的电子排布式为[Ar]______________________;上述材料中所含元素的基态原子中,未成对电子数最多的是___________(填元素符号)。
(2)AsCl3分子中砷的杂化类型是___________;AsO43-的空间构型是___________。
(3)电子亲和能是反映元素性质的参数之一,电子亲和能指基态气态原子得1个电子形成负一价阴离子时释放的能量(kJ·mol-1),第四周期主族元素Ga、Ge、As、Se、Br的电子亲和能大小变化如图所示。砷的电子亲和能“突变”的主要原因是_________________________________。

(4)铁及其离子易形成配离子,如[Fe(CN)6]3-、[Fe(CN)6]4-、Fe(CO)5等。配位原子提供孤电子对的能力与元素的电负性大小有关,电负性越大,其原子不容易提供孤电子对,则Fe(CO)5中提供孤电子对的原子是__ (填元素符号);与CO互为等电子体的分子是___________。
(5)已知:CaO、K2S的熔点分别为2572℃、840℃,二者熔点差异的主要原因是___________。
(6)氧化镍晶胞如图1所示,单原子层氧化镍的结构如图2所示。

①图1中,原子坐标参数:A(0,0,0)、B(![]() ,0,
,0,![]() ),则C原子的坐标参数为___________。
),则C原子的坐标参数为___________。
②图2中,已知氧离子半径为apm(忽略镍离子半径),NA是阿伏加德罗常数的值。每平方米含氧化镍的质量为___________g。(提示:将图2中氧离子切割成正六边形作最小基元)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组按如下实验流程探究海带中碘含量的测定和碘的制取。
实验(一) 碘含量的测定

实验(二) 碘的制取
另制海带浸取原液,甲、乙两种实验方案如下:
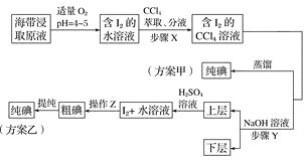
已知:3I2+6NaOH===5NaI+NaIO3+3H2O。
(1)实验(一) 中的仪器名称:仪器A________, 仪器 B________。
(2)①分液漏斗使用前须检漏,检漏方法为__________________。
②步骤X中,萃取后分液漏斗内观察到的现象是___________________。
③下列有关步骤Y的说法,正确的是________。
A 应控制NaOH溶液的浓度和体积
B 将碘转化成离子进入水层
C 主要是除去海带浸取原液中的有机杂质
D NaOH溶液可以由乙醇代替
④实验(二) 中操作Z的名称是________。
(3)方案甲中采用蒸馏不合理,理由是________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com