
����Ŀ��ú����Ҫ��Դ��ȼú���ͷ�SO2��CO���ж����塣�����ж�������о���ʵ����δֹͣ�����������գ�
I.��CaSO4����CO��CaSO4��CO�ɷ�������������Ӧ��
��Ӧ�٣�CaSO4��s��+4CO��g��![]() CaS��s��+4CO2��g��+175.6kJ
CaS��s��+4CO2��g��+175.6kJ
��Ӧ�ڣ�CaSO4��s��+4CO��g��![]() CaO��s��+SO2��g��+CO2��g����218.4kJ
CaO��s��+SO2��g��+CO2��g����218.4kJ
(1)д����Ӧ�ٵ�ƽ�ⳣ������ʽ��_____________��һ�������µ��ܱ������У�����Ӧ����ƽ�����ʹ��Ӧ��K�ļ�С����Ҫ�ı�ķ�Ӧ������______________����Ӧ�ڵ�K___________��ѡ���ţ�����Ӧ�ٵ�v(CO2)��__________��ѡ���ţ���
a. ���� b. ��С c. ���� d. ���ж�
��2����ȫ��ͼ�з�Ӧ�ڵ������仯ʾ��ͼ_______________������ע�������������Ĵ���λ�ü���Ӧ��ЧӦ��ֵ��

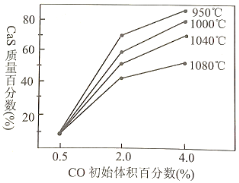
��3����ͼ�Dz�ͬ�¶��£�CO��ʼ����ٷ�����ƽ��ʱ���������CaS�����ٷ����Ĺ�ϵ���ߡ�д�����ֽ���SO2�������Ĵ�ʩ___________________________________��
II. Fe2(SO4)3��Һ�ɳ�ȥú���Ի�����FeS2����ʽ���ڵ���Ԫ�أ���Ӧ���£�8H2O + FeS2+ 7Fe2(SO4)3��15FeSO4+ 8H2SO4
(4)�������ת�Ƶ���Ŀ�ͷ���________����ԭ������_______��
(5)����������Ӧ��Fe2(SO4)3�Ƿ��������ʵ�鷽����___________________________��
(6)�÷������ŵ�֮һ��Fe2(SO4)3����������Ӧ�����Һ��ͨ��___________�����ܴﵽʹFe2(SO4)3������Ŀ�ģ������Ҽ�����
���𰸡�![]() �����¶� a a
�����¶� a a 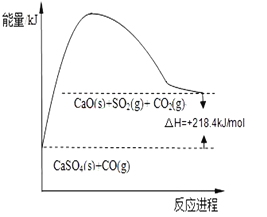 ����CO��ʼ����ٷ���Ϊ
����CO��ʼ����ٷ���Ϊ![]() ���ҡ������¶���
���ҡ������¶���![]() ���ҵ�
���ҵ� 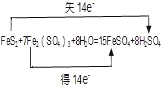
![]() ȡ�ϲ���Һ���μӼ���KSCN��Һ����������������
ȡ�ϲ���Һ���μӼ���KSCN��Һ����������������![]() �������꣬����Һ�����û������ ����
�������꣬����Һ�����û������ ����
��������
(1)����ƽ�ⳣ������д����Ӧ�ٵ�ƽ�ⳣ��k�ı���ʽ����Ӧ�������Ƿ��ȷ�Ӧ����Ӧ�����������ȷ�Ӧ�������¶ȣ���Ӧ��ƽ�������ƶ�����Ӧ��ƽ�������ƶ���
(2)���Ȣ����������ȷ�Ӧ����Ӧ�ȡ�H=+218.4kJ/mol��
(3)����SO2�����������ǿ�������ʹ��Ӧ�ڷ����Ŀ����Լ�С��������CaO��SO2���գ���ͼ���֪�¶���950������ʱCaS�����ٷ������CO��ʼ����ٷ���Ϊ4.0%����ʱCaS�����ٷ������SO2��������С��
(4)��Ӧ��2��-1��Sԭ�ӱ���������2��H2SO4���ӣ�ʧȥ14�����ӣ�ͬʱ14��+3��Fe3+�õ�14����������Fe2+������FeSO4�ǻ�ԭ����ݴ˱������ת�Ƶ���Ŀ�ͷ���
(5)��Ӧ��Fe2(SO4)3�Ƿ�������ֻ��Ҫ������Һ���Ƿ���Fe3+������ȡ�ϲ���Һ�μ�KSCN��Һ��������ɫ�仯�жϣ�
(6) FeSO4�л�ԭ�ԣ�ʹFeSO4ת��ΪFe2(SO4)3�����Ҽ������Լ��ǿ�����
��1����Ӧ�ٻ�ѧƽ�ⳣ��KΪc4(CO2)/c4(CO)����Ӧ��Ϊ���ȷ�Ӧ�������¶ȣ���Ӧ��������ƽ�������ƶ�����ѧƽ�ⳣ��K��С����Ӧ��Ϊ���ȷ�Ӧ�������¶ȣ�ƽ�������ƶ�����ѧƽ�ⳣ��K���ʴ�Ϊ��c4(CO2)/c4(CO)�������¶���a��a��
��2����Ӧ��Ϊ���ȷ�Ӧ����H=+218.4kJ/mol����Ӧ��������С�����������������������仯ͼʾΪ��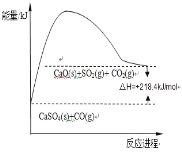 ���ʴ�Ϊ��
���ʴ�Ϊ��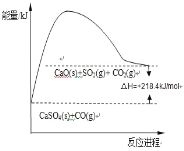 ��
��
��3����ͼ���֪�¶���950������ʱCaS�����ٷ������CO��ʼ����ٷ���Ϊ4.0%����ʱCaS�����ٷ��������Ӧ�ٵ���С����Ӧ�ڵ��ȴ�SO2����������С����Ӧ�����ɵ�SO2���յ����Խ���SO2���������ʴ�Ϊ������CO��ʼ����ٷ���Ϊ4.0%���ң����Ʒ�Ӧ�¶���950�����ң��������CaO�ȣ�
��4���ɷ���ʽ��֪����Ӧ��SԪ�ػ��ϼ����ߣ�FeS2��������FeԪ�ػ��ϼ۽��ͣ�Fe2(SO4)3����ԭ��FeSO4�ǻ�ԭ�����Ӧ�е�ʧ������ĿΪ14���ʴ�Ϊ�� ��FeSO4��
��FeSO4��
��5����Fe2(SO4)3�������꣬��Һ��Ӧ�ò�����Fe3+���ӣ�����Fe3+���ӿ�����KSCN���飬ʵ�鷽��Ϊ����ȡ�ϲ���Һ���μӼ���KSCN��Һ����������������Fe2(SO4)3�������꣬����Һ�����û���������ʴ�Ϊ��ȡ�ϲ���Һ���μӼ���KSCN��Һ����������������Fe2(SO4)3�������꣬����Һ�����û�����ꣻ
��6��FeSO4�л�ԭ�ԣ��������������Խ�FeSO4��������Fe2(SO4)3���÷��������Ҽ������ʴ�Ϊ��������


 �����Ļ���������人������ϵ�д�
�����Ļ���������人������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ϼ�G�����������кܶ���;,��ϳ�·������:

��֪:��R1��CHO+R2��CH2��CHO![]()
![]() (R1��R2������������ԭ��)
(R1��R2������������ԭ��)
��D��A��Ϊͬϵ��;����ͬ������,D����������������ܶ�Ϊ39��
(1)A��������____,G�к��������ŵ�������____��
(2)�ڵķ�Ӧ������____,B��F�Ľṹ��ʽ�ֱ�Ϊ______��______��
(3)д��һ���ܼ���A��D���Լ�:______;C�ж���ͬ���칹��,�������ڷ����廯�������____�֡�
(4)д����Ӧ�ٵĻ�ѧ����ʽ:_____________��
(5)G��ͬ���칹�� ��һ����Ҫ��ҩ���м���,��ϳ�·����G����,����
��һ����Ҫ��ҩ���м���,��ϳ�·����G����,����![]() Ϊԭ��������ĺϳ�·��(��������ԭ����ѡ)_________��
Ϊԭ��������ĺϳ�·��(��������ԭ����ѡ)_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�У�A�ǹ���������ʣ�ȼ��ʱ����ʻ�ɫ��

��1��д�����з��������������ʵĻ�ѧʽ��
A____________��B____________��C____________��D____________��
��2��д������ת���Ļ�ѧ����ʽ��
��A��B________________________________________��
��B��D________________________________________��
��A��C________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�Ksp[Mg(OH)2]=1.1��10-11�� Ksp(AgCl)=1.8��10-10��Ksp(Ag2CrO4)=1.9��10-12��������������ȷ������ ��
A. Ũ�Ⱦ�Ϊ2��10-5mol/L��AgNO3��Һ��NaCl��Һ�������ϣ��а�ɫ��������
B. ��0.001mol/L��AgNO3��Һ����Ũ�Ⱦ�Ϊ0.001mol/L��KCl��K2CrO4�����Һ�У��Ȳ���AgCl����
C. c(Mg2+)Ϊ0.11mol/L����Һ��Ҫ����Mg(OH)2��������Һ��pHҪ������9����
D. ������������ʱ����Ag2CrO4ˮ��Һ�м�������K2CrO4��������Һ��c(Ag+)����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ�п��ܺ���![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() �ֱ�ȡ����
�ֱ�ȡ����![]() �����Һ�������ԣ�
�����Һ�������ԣ�![]() �μ���ˮ�͵�����������ʼ������������Ϊȷ������Һ����ɣ�����ļ��鷽�����Լ���
�μ���ˮ�͵�����������ʼ������������Ϊȷ������Һ����ɣ�����ļ��鷽�����Լ���
A. ��ɫ��Ӧ B. NaOH��Һ�����ȣ�
C. ![]() �ữ
�ữ![]() ��Һ D.
��Һ D. ![]() ����
����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ����������(��Ҫ�ɷ�ΪAl2O3����Fe2O3����)Ϊԭ��ұ�����Ĺ����������£�

����������ȷ����
A. �Լ�X����������������Һ��Ҳ����������
B. ��Ӧ�������˺����ó���Ϊ��������
C. ͼ����ʾת����Ӧ������������ԭ��Ӧ
D. ��Ӧ���Ļ�ѧ����ʽΪNaAlO2��CO2��2H2O=Al(OH)3����NaHCO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��Ӧ�ǻ�ѧʵ������ı��ʣ����������ش��������⣺
��1����BaCl2��Һ��ͨ��SO2���壬δ���������ɣ�����ͨ���������е���һ�����ʣ���ͨ��SO2���ܿ����������� ������ţ���
��Cl2��NaOH��HCl��FeCl3��Һ��CO2��H2S��NH3��NaClO��Һ
��2��ͼ��A��B��C֮�������µ�ת����ϵ������������ȥ����
![]()
������˵����ȷ����
a����A�Ƿǽ������ʣ���C��ˮ��Ӧ�������������ǿ�������
b����A�ǽ������ʣ���C��ˮ��Ӧ�������������ǿ��
c����A�ǻ������C��ˮ��Ӧ�������������ǿ��
��3�����ӷ���ʽ����Ҫ�Ļ�ѧ����������й����ӷ���ʽ��һЩ����۵㣬�������б�����Ӧ�ġ����ӷ���ʽ������Щ�۵㣮
��Ӧ�������������ѡȡ��Na��Fe��H2O��H2SO4��HCl��NaOH��Ba��OH��2��CuSO4
����۵� | ���ġ����ӷ���ʽ | |
�� | ���е����ӷ���ʽ�����Ա�ʾһ�ѧ��Ӧ |
|
�� | ��������кͷ�Ӧ���ɱ�ʾΪ H++OH���TH2O |
|
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й�����ͼ��ʾ�绯ѧװ�õķ�����ȷ����

A. ��XΪֱ����Դ��YΪͭ������������Fe���϶�ͭ
B. ��XΪֱ����Դ��YΪ̼���Ӹ�������Fe��������
C. ��XΪ�����ƣ�YΪп������SO42������Fe��
D. ��XΪ���ߣ�YΪͭ������Fe��������ԭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ����������ԭ��Ӧ��2KMnO4��10FeSO4��8H2SO4=2MnSO4��5Fe2(SO4)3��K2SO4 ��8H2O�������ԭ��أ�������װ�б���KCl��Һ������˵����ȷ����

A. b�缫�Ϸ�����ԭ��Ӧ
B. ���·���ӵ������Ǵ�a��b
C. ��ع���ʱ�������е�SO42��������ձ�
D. a�缫�Ϸ����ķ�ӦΪ��MnO4����8H����5e�� = Mn2����4H2O
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com