
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:

下列叙述正确的是
A. 试剂X可以是氢氧化钠溶液,也可以是盐酸
B. 反应①、过滤后所得沉淀为氢氧化铁
C. 图中所示转化反应都不是氧化还原反应
D. 反应②的化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
【题目】工业上制硫酸的主要反应之一为2SO2(g)+O2(g)![]() 2SO2(g),反应过程中能量的变化如图所示。
2SO2(g),反应过程中能量的变化如图所示。
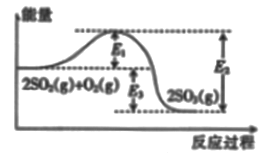
(1)由图可知该反应的正反应为_________ (填“吸热”或“放热”) 反应。
(2)向反应体系中加入催化剂后,图中E1_______(填“增大”“或“减小”或“不变”,下同),E3______。
(3)已知:2H2S(g)+O2(g)==2S(s)+2H2O(g) ΔH=-442.4kJ/mol
S(s)+O2(g)==SO2(g) ΔH=-297.0 kJ/mol 。
若H2S(g)与O2(g)反应产生SO2(g)和H2O(g),则消耗0.5mol H2S时,反应中转移的电子总数为_______(用NA 表示阿伏加德罗常数的数值),放出的热量为_______kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用化学平衡移动原理解释的是
A. 光照新制的氯水时,溶液的pH逐渐减小
B. 红棕色的NO2,加压后颜色先变深后变浅,但比原来要深
C. 500℃时比室温更利于合成氨
D. 用排饱和食盐水法收集Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若在加入铝粉能放出氢气的溶液中,分别加入下列各组离子,一定能大量共存的是
A. NH![]() 、SO
、SO![]() 、CO
、CO![]() 、K+ B. Na+、Ba2+、Ca2+、HCO
、K+ B. Na+、Ba2+、Ca2+、HCO![]()
C. Mg2+、SO![]() 、K+、Cl- D. K+、Cl-、Na+、SO
、K+、Cl- D. K+、Cl-、Na+、SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】控制变量是科学研究重要方法。由下列实验现象一定能得出相应结论的是
选项 | A | B |
装 置 图 |
|
|
现象 | 右边试管产生气泡较快 | 左边棉球变棕黄色,右边棉球变蓝色 |
结论 | 催化活性:Fe3+>Cu2+ | 氧化性:Br2>I2 |
选项 | C | D |
装 置 图 |
|
|
现象 | 试管中先出现淡黄色固体,后出现黄色固体 | 试管中液体变浑浊 |
结论 | Ksp:AgCl>AgBr>AgI | 非金属性:C>Si |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO2、NO、CO污染物处理,对建设美丽中国具有重要意义。
(1)①NO2(g)+CO(g)==CO2(g)+NO(g)△H1=-234.00kJ/mol
②1/2N2(g)+1/2O2(g)=NO(g)△H2=-89.75kJ/mol
③2NO(g)+O2(g)==2NO2(g)△H3=-112.30kJ/mol。
若NO2气体和CO气体反应生成无污染气体,其热化学方程式为______________。
(2)某温度下,向10L密闭容器中分别充入0.1molNO2和0.2molCO,发生反应:2NO2(g)+4CO(g)=N2(g)+4CO2(g),经10min反应达到平衡,容器的压强变为原来的![]() 。
。
①0~10min内,CO的平均反应速率v(CO)=__________;
②若容器中观察到_____,可判断该反应达到平衡状态;
③为增大污染物处理效率,起始最佳投料比为______;
④平衡后,仅将CO、CO2气体浓度分别增加一倍,则平衡_____(填“右移”或“左移”或“不移动”)。

(3)在高效催化剂作用下用NH3还原NO2进行污染物处理。
①相同条件下,选用A、B、C三种催化剂进行反应,生成氮气的物质的量与时间变化如图a。活化能最小的是______(用E(A)、E(B)、E(C)表示三种催化剂下该反应活化能)。
②在催化剂A作用下测得相同时间处理NO2的量与温度关系如图b。试说明图中曲线先增大后减小的原因________(假设该温度范围内催化效率相同)。

(4)有人设想在含有NO2的酸性污水中加人填充有铝粉的多孔活性炭颗粒进行水的净化。试结合电极反应说明多孔活性炭的主要作用_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2O2可用作漂白剂和呼吸面具中的供氧剂
(1)某学习小组发现:在盛有Na2O2的试管中加入足量水,固体完全溶解,并立即产生大量气泡,当气泡消失后,向其中滴入1~2滴酚酞溶液,溶液变红;将试管轻轻振荡,红色很快褪去;此时再向试管中加入少量MnO2粉末,又有气泡产生。
①写出Na2O2作供氧剂的化学反应方程式____________;
②使酚酞溶液变红是因为________,红色褪去的可能原因是___________;
③加入MnO2反应的化学方程式为____________;
(2)Na2O2有强氧化性,H2具有还原性,有同学猜想Na2O2与H2能反应。为了验证此猜想,该小组同学进行加下实验,实验步骤和现象如下:
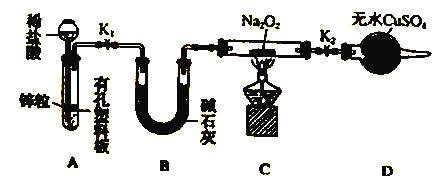
步骤1:按上图组装仪器(图中夹持仪器省略),检查气密性,装入药品。
步骤2:打开K1、K2,产生的氢气流经装有Na2O2的硬质玻璃管,一段时间后没有任何现象。
步骤3: ,开始加热,观察到硬质玻璃管内Na2O2开始熔化,淡黄色的粉末变成了白色固体,干燥管内硫酸铜未变蓝色。
步骤4:反应后撤去酒精灯,待硬质玻璃管冷却后关闭K1。
①添加稀盐酸的仪器名称是______,B装置的作用_________。
②步骤3在点燃C处酒精灯前必须进行的操作是______________;
③装置D的目的是_________;
④你得到的结论是________(若能反应请用化学方程式表示);
⑤该实验设计中存在着明显不足之处,应该如何改进:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用足量的锌粒和100mL稀硫酸制备氢气,当收集到标准状况下1.12L H2时,反应停止,下列说法不正确的是
A. 稀硫酸中H+的浓度是0.5mol/L B. 消耗硫酸物质的量是0.05 mol
C. 消耗锌的质量是3.25g D. 氢气中可能混有水蒸气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国很早就使用青铜器,由于时间久远,其表面有一层“绿锈”,“绿锈”俗称“铜绿”,是铜和空气中的水蒸气、CO2、O2作用产生的,化学式为[Cu2(OH)2CO3],“铜绿”能跟酸反应生成铜盐、CO2和H2O。某同学利用以下反应实现了“铜→铜绿→……→铜”的转化。
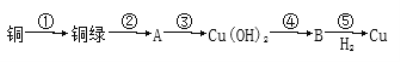
(1)从物质分类标准看,“铜绿”属于______(填字母)。
A.酸 B.碱 C.盐 D.氧化物
(2)写出B的化学式:____________。
(3)请写出铜绿与盐酸反应的离子方程式:________________________。
(4)上述转化过程中属于氧化还原反应的是_______________(填序号)
(5)铜绿在受热时可直接分解生成物质B、CO2和水,其分解的化学方程式为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com