
【题目】工业上制硫酸的主要反应之一为2SO2(g)+O2(g)![]() 2SO2(g),反应过程中能量的变化如图所示。
2SO2(g),反应过程中能量的变化如图所示。
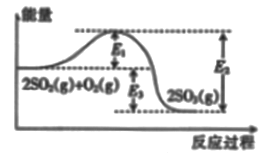
(1)由图可知该反应的正反应为_________ (填“吸热”或“放热”) 反应。
(2)向反应体系中加入催化剂后,图中E1_______(填“增大”“或“减小”或“不变”,下同),E3______。
(3)已知:2H2S(g)+O2(g)==2S(s)+2H2O(g) ΔH=-442.4kJ/mol
S(s)+O2(g)==SO2(g) ΔH=-297.0 kJ/mol 。
若H2S(g)与O2(g)反应产生SO2(g)和H2O(g),则消耗0.5mol H2S时,反应中转移的电子总数为_______(用NA 表示阿伏加德罗常数的数值),放出的热量为_______kJ。
【答案】 放热 减小 不变 3NA 259.1
【解析】(1)由图像可知反应物总能量大于生成物总能量,则该反应的正反应为放热反应,故答案为:放热;
(2)E1为活化能,E3为反应热,加入催化剂,可降低反应的活化能,但反应热不变,因此E1减小,E3不变,故答案为:减小;不变;
(3)已知:①2H2S(g)+O2(g)═2S(s)+2H2O(g)△H=-442.4kJmol-1;②S(s)+O2 (g)═SO2 (g)△H=-297.0kJmol-1,利用盖斯定律,将①+②×2可得2H2S(g)+3O2(g)═2SO2(g)+2H2O(g) △H=-1036.4kJmol-1。则消耗0.5molH2S时,反应中转移的电子为3mol,数目为3NA,放出的热量为1036.4kJ ×![]() =259.1kJ,故答案为:3NA;259.1。
=259.1kJ,故答案为:3NA;259.1。


科目:高中化学 来源: 题型:
【题目】对SO2与CO2说法正确的是( )
A. 都是直线形结构
B. 中心原子都采取sp杂化
C. S原子和C原子上都没有孤对电子
D. SO2为V形结构,CO2为直线形结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)(2018·山东省青岛市5月第二次模拟检测)有机物I(分子式为C19H20O4)属于芳香酯类物质,是一种调香剂,其合成路线如下:
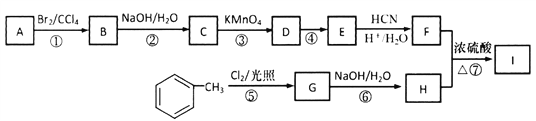
已知:①A属于脂肪烃,核磁共振氢谱显示有2组峰,面积比为3:1,其蒸汽在标准状况下密度为2.5g·L-1;D分子式为C4H8O3;E分子式为C4H6O2,能使溴水褪色。
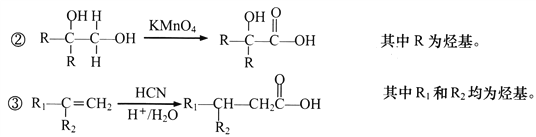
回答下列问题:
(1)A的结构简式为___________________;分子中共面的原子至少有__________个。
(2)D中官能团的名称是______________________。
(3)反应④的化学方程式为____________________________________。
(4)E的同系物K比E多一个碳原子,K有多种链状同分异构体,其中能发生银镜反应且能水解的有____________种。
(5)反应①~⑦属于取代反应的是__________________________________(填序号)。
(6)反应⑦的化学方程式为_______________________________________。
(7)参照上述合成路线,以 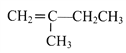 为原料(无机试剂任选),经4步反应制备可降解塑料
为原料(无机试剂任选),经4步反应制备可降解塑料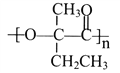 _____________________。
_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种Cu- Li可充电电池的工作原理如图所示,其中非水系电解液和水系电解液被锂离子固体电解质陶瓷片( LISICON)隔开。下列说法正确的是
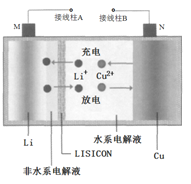
A. 陶瓷片允许水分子通过
B. 电池放电时,N极上发生氧化反应
C. 电池充电时,接线柱B应与外接直流电源的负极相连
D. 电池充电时,阴极反应为Li++e-=Li
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学兴趣小组设计以下实验方案,测定某已部分变质的小苏打样品中碳酸钠的质量分数。
[方案一]称取一定质量样品,置于坩埚中加热至恒重后,冷却,称量剩余固体质量,计算。则坩埚中发生反应的化学方程式为____________________________。
[方案二]称取一定质量样品,置于小烧杯中,加适量水溶解;向小烧杯中加入足量氢氧化钡溶液,过滤、洗涤、干燥沉淀,称量固体质量,计算。(已知:Ba2++OH-+HCO3-=BaCO3↓+H2O)。
(1)过滤操作中,除了烧杯、漏斗外,还要用到的玻璃仪器为__________。
(2)实验中判断沉淀是否完全的方法是_________________________。
[方案三]按如下图所示装置进行实验:
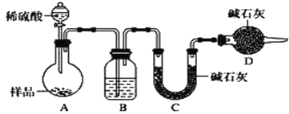
(1)D装置的作用是______________________,分液漏斗中__________(填“能”或“不能”)用盐酸代替稀硫酸进行实验。
(2)实验前称取17.90g样品,实验后测得C装置增重8.80 g,则样品中碳酸钠的质量分数为_____。
(3)根据此实验测得的数据,测定结果有误差,因为实验装置还存在一个明显缺陷是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作规范且能达到实验目的的是
操作 | 目的 | |
A | 称取5.0gCuSO4·5H2O加入27.0g水中,搅拌溶解 | 配制10%CuSO4溶液 |
B | 先用稀盐酸洗涤,再用水清洗 | 洗涤分解KMnO4制O2的试管 |
C | 用玻璃棒蘸取溶液,点在干燥的pH试纸上,片刻后与标准比色卡比较并读数 | 测定0.05mol.L-1NaClO溶液的pH |
D | 将粗碘放入烧杯中,烧杯口放一盛满冷水的烧瓶,隔石棉网对烧杯加热,然后收集烧瓶外壁的固体 | 提纯混有NH4Cl的粗碘 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:

下列叙述正确的是
A. 试剂X可以是氢氧化钠溶液,也可以是盐酸
B. 反应①、过滤后所得沉淀为氢氧化铁
C. 图中所示转化反应都不是氧化还原反应
D. 反应②的化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com