
【题目】下列离子既有氧化性也有还原性的一组是( )
A.S2-B.Fe3+C.MnO4-D.Fe2+
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案科目:高中化学 来源: 题型:
【题目】氧化锂(Li2O)是锂电池工业的重要原料。以粗碳酸锂为原料制备氧化锂的一种工艺流程如下:

注:常温下,碳酸锂微溶于水,氢氧化锂可溶于水。
(1)反应Ⅰ中通入CO2需加压的原因是______。
(2)①反应Ⅱ生成LiOH的化学方程式为______。
②石灰乳的固液比[Ca(OH)2的质量与H2O的体积之比]对LiOH产率和滤液中LiOH浓度的影响如右图所示。实际生产中选择固液比25 g·L-1,若固液比过低对后续操作的不利影响是______。

(3)浓缩、结晶所得LiOH·H2O通过灼烧得到Li2O。
①LiOH·H2O中常含有少量的Li2CO3,但该物质对所制Li2O得纯度无影响,其原因是______。
②将LiOH·H2O置于不同坩埚内,在空气中充分灼烧,反应后固体产物的XRD图谱如右图所示(XRD图谱可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。欲制得高纯氧化锂最适宜的坩埚是______。铁坩埚中发生反应的化学方程式为______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L的密闭容器中,发生以下反应:2A(g)+B(g)![]() 2C(g)+D(g)。若最初加入的A和B都是3mol,在前10sA的化学反应速率为0.12mol·L-1·s-1,则10s时,容器中B的物质的量是
2C(g)+D(g)。若最初加入的A和B都是3mol,在前10sA的化学反应速率为0.12mol·L-1·s-1,则10s时,容器中B的物质的量是
A. 0.6mol B. 1.2mol C. 1.8mol D. 2.4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一恒容密闭烧瓶中,25℃时存在平衡:2NO2(g) ![]() N2O4(g) △H<0。将烧瓶置于100℃的水中,则下列物理量中不会改变的是
N2O4(g) △H<0。将烧瓶置于100℃的水中,则下列物理量中不会改变的是
A.颜色 B.密度 C.N2O4的浓度 D.压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一定量含有Na2O杂质的Na2O2试样,用下图的实验装置测定Na2O2试样的纯度。(可供选用的反应物只有CaCO3固体、6 mol·L1硫酸、6 mol·L1盐酸和蒸馏水)

回答下列问题:
(1)装置A中发生反应的化学方程式是______________________________________。
(2)装置B的作用是______________,装置C的作用是______________,装置E的作用是_____________。
(3)装置D中发生反应的化学方程式是______________________________________。
(4)若开始时测得样品的质量为2.0 g,反应结束后测得气体体积为224 mL(标准状况),则Na2O2试样的纯度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,既是化合反应,又是氧化还原反应的是
A. 生石灰与水反应:CaO+ H2O =Ca(OH)2
B. 氯气通入溴化钠溶液:C12+2NaBr= 2NaCl+Br2
C. 铁和氯气反应:2Fe+3Cl2![]() 2FeC13
2FeC13
D. 氯化钠溶液和浓硫酸混合加热:2NaCl+H2SO4(浓)![]() Na2SO4+2HCl↑
Na2SO4+2HCl↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有以下物质相互转化。试回答:
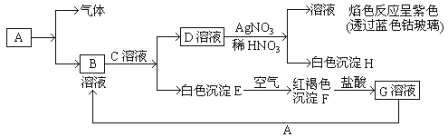
(1)写出B的化学式_____________________D的化学式________________。
(2)写出由E转变成F的化学方程式_____________________________________。
(3)写出用KSCN鉴别G溶液的离子方程式____________________________;向G溶液加入A的有关离子反应方程式________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制硫酸的主要反应之一为2SO2(g)+O2(g)![]() 2SO2(g),反应过程中能量的变化如图所示。
2SO2(g),反应过程中能量的变化如图所示。
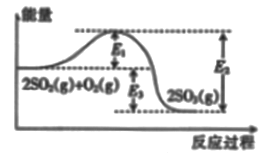
(1)由图可知该反应的正反应为_________ (填“吸热”或“放热”) 反应。
(2)向反应体系中加入催化剂后,图中E1_______(填“增大”“或“减小”或“不变”,下同),E3______。
(3)已知:2H2S(g)+O2(g)==2S(s)+2H2O(g) ΔH=-442.4kJ/mol
S(s)+O2(g)==SO2(g) ΔH=-297.0 kJ/mol 。
若H2S(g)与O2(g)反应产生SO2(g)和H2O(g),则消耗0.5mol H2S时,反应中转移的电子总数为_______(用NA 表示阿伏加德罗常数的数值),放出的热量为_______kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用化学平衡移动原理解释的是
A. 光照新制的氯水时,溶液的pH逐渐减小
B. 红棕色的NO2,加压后颜色先变深后变浅,但比原来要深
C. 500℃时比室温更利于合成氨
D. 用排饱和食盐水法收集Cl2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com