
【题目】实验室用足量的锌粒和100mL稀硫酸制备氢气,当收集到标准状况下1.12L H2时,反应停止,下列说法不正确的是
A. 稀硫酸中H+的浓度是0.5mol/L B. 消耗硫酸物质的量是0.05 mol
C. 消耗锌的质量是3.25g D. 氢气中可能混有水蒸气
【答案】A
【解析】
本题主要考查物质的量在化学反应方程式中的应用。由题可知,发生反应Zn+H2SO4===ZnSO4+H2![]() ,因锌过量,故H2SO4完全反应,生成0.05molH2,根据化学方程式中各物质的化学计量数之比,等于粒子数目之比,等于参加反应的物质的物质的量之比进行判断。
,因锌过量,故H2SO4完全反应,生成0.05molH2,根据化学方程式中各物质的化学计量数之比,等于粒子数目之比,等于参加反应的物质的物质的量之比进行判断。
由Zn+H2SO4===ZnSO4+H2![]()
1 1
0.05mol 0.05mol
A.c(H2SO4)=![]() =
=![]() ,即c(H+)=0.5×2mol/L=1mol/L,错误;
,即c(H+)=0.5×2mol/L=1mol/L,错误;
B.由上述分析可知,消耗H2SO4的物质的量为0.05mol,正确;
C.消耗锌的质量![]() ,正确;
,正确;
D.该反应会放出热量,即随着H2的逸出,可能会有水蒸气混入H2中,正确。


 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:
【题目】下列实验操作规范且能达到实验目的的是
操作 | 目的 | |
A | 称取5.0gCuSO4·5H2O加入27.0g水中,搅拌溶解 | 配制10%CuSO4溶液 |
B | 先用稀盐酸洗涤,再用水清洗 | 洗涤分解KMnO4制O2的试管 |
C | 用玻璃棒蘸取溶液,点在干燥的pH试纸上,片刻后与标准比色卡比较并读数 | 测定0.05mol.L-1NaClO溶液的pH |
D | 将粗碘放入烧杯中,烧杯口放一盛满冷水的烧瓶,隔石棉网对烧杯加热,然后收集烧瓶外壁的固体 | 提纯混有NH4Cl的粗碘 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:

下列叙述正确的是
A. 试剂X可以是氢氧化钠溶液,也可以是盐酸
B. 反应①、过滤后所得沉淀为氢氧化铁
C. 图中所示转化反应都不是氧化还原反应
D. 反应②的化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,不属于氧化还原反应的是
A. 2Na + 2H2O =2NaOH + H2↑ B. 2Na + O2![]() Na2O2
Na2O2
C. 2Na2O2 + 2CO2=2Na2CO3+O2 D. NaHCO3+HCl=NaCl+H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关离子检验的说法正确的是
A. 加入稀盐酸产生无色气体,气体能使澄清石灰水变浑浊,原溶液中一定含有CO![]()
B. 加入稀盐酸无明显现象,再加入硝酸银溶液产生白色沉淀,原溶液中一定含有Cl―
C. 加入BaCl2溶液产生白色沉淀,再加入稀盐酸沉淀不溶解,原溶液中一定含有SO![]()
D. 加入KSCN溶液,呈现血红色,原溶液中一定含有Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸锰(MnCO3)是一种高性能磁性材料。以软锰矿粉(主要含MnO2,还含有少量的Fe2O3、Al2O3等杂质)为原料制取MnCO3的流程如下:

已知:“沉锰”反应为:Mn2+ + 2HCO![]() == MnCO3↓+ H2O + CO2↑
== MnCO3↓+ H2O + CO2↑
(1)“酸浸”时发生的主要反应为:2Fe2+ + MnO2+ 4H+ == 2Fe3+ + Mn2+ + 2H2O。除此以外,还发生的反应离子方程式为________。(任写一个)
(2)“沉锰”工序中,实验测得MnCO3的产率与溶液pH、反应时间t的关系如图所示。反应要控制pH在7左右的理由是_________。(答两点)

(3)“过滤Ⅱ”所得滤液中溶质的主要成分是_________。
(4)为测定某软锰矿中二氧化锰的质量分数,准确称量1.800g软锰矿样品,加入4.020 g草酸钠(Na2C2O4)固体,再加入足量的稀硫酸并加热(杂质不参加反应),充分反应后冷却,过量的Na2C2O4用0.2000 mol/L高锰酸钾溶液进行滴定,当滴入30.00mL溶液时恰好完全反应。已知高锰酸钾、二氧化锰在酸性条件下均能将草酸钠(Na2C2O4)氧化:MnO2 + C2O![]() + 4H+
+ 4H+ ![]() Mn2+ + 2CO2↑+ 2H2O,MnO4-+ C2O
Mn2+ + 2CO2↑+ 2H2O,MnO4-+ C2O![]() + H+ — Mn2+ + CO2↑+ H2O (未配平)。求该软锰矿中二氧化锰的质量分数_________(写出计算过程)。
+ H+ — Mn2+ + CO2↑+ H2O (未配平)。求该软锰矿中二氧化锰的质量分数_________(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某离子反应涉及H2O、Cr2O72―、NO2―、H+、NO3―、Cr3+六种微粒,已知反应过程中NO2-浓度变化如图所示,下列说法不正确的是
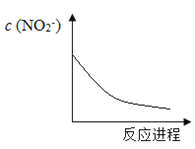
A. Cr2O72-中Cr化合价是+6价
B. 反应的氧化产物是NO3-
C. 消耗1mol氧化剂,转移电子6mol
D. 随着反应的进行,溶液中的H+ 浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚氨酯类高分子材料PU用途广泛,其合成反应为:

下列说法不正确的是
A. HO(CH2)4OH的沸点高于CH3CH2CH2CH3
B. 高分子材料PU在强酸、强碱中能稳定存在
C. 合成PU的两种单体的核磁共振氢谱中均有3个吸收峰
D. 以1,3-丁二烯为原料,可合成HO(CH2)4OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在金属Pt、Cu和铱(Ir)的催化作用下,密闭容器中的H2可高效转化酸性溶液中的硝态氮(NO3)以达到消除污染的目的。其工作原理的示意图如下:

下列说法不正确的是
A. Ir的表面发生反应:H2 + N2O == N2 + H2O
B. 导电基体上的负极反应:H2-2e == 2H+
C. 若导电基体上只有单原子铜,也能消除含氮污染物
D. 若导电基体上的Pt颗粒增多,不利于降低溶液中的含氮量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com