
【题目】化学反应是化学实验现象的本质,根据描述回答下列问题:
(1)在BaCl2溶液中通入SO2气体,未见沉淀生成,若先通入或加入下列的另一种物质,再通入SO2不能看到沉淀的有 (填序号).
①Cl2②NaOH③HCl④FeCl3溶液⑤CO2⑥H2S⑦NH3⑧NaClO溶液
(2)图中A、B、C之间有以下的转化关系(副产物已略去);
![]()
则下列说法正确的是
a.若A是非金属单质,则C与水反应的生成物可能是强酸或弱酸
b.若A是金属单质,则C与水反应的生成物可能是强碱
c.若A是化合物,则C与水反应的生成物可能是强酸
(3)离子方程式是重要的化学用语.下列是有关离子方程式的一些错误观点,请在下列表格相应的“离子方程式”否定这些观点.
反应物从下列物质中选取:Na、Fe、H2O、H2SO4、HCl、NaOH、Ba(OH)2、CuSO4
错误观点 | “否定的”离子方程式 | |
① | 所有的离子方程式均可以表示一类化学反应 |
|
② | 所有酸碱中和反应均可表示为 H++OH﹣═H2O |
|
【答案】(1)③⑤;(2)2H++SO42﹣+Ba2++2OH﹣=BaSO4↓+2H2O.
【解析】(1)①Cl2具有氧化性,在溶液中将SO2氧化为SO42﹣离子,生成沉淀BaSO4,故①不选;
②NaOH与二氧化硫反应生成亚硫酸钠,溶液中生成大量的SO32﹣离子,生成沉淀BaSO3,故②不选;
③HCl与SO2都不与BaCl2反应,通入SO2与HCl都不会生成沉淀,故③选;
④FeCl3溶液具有氧化性,将SO2氧化为SO42﹣离子,生成沉淀BaSO4,故④不选;
⑤SO2与CO2都不与BaCl2反应,并且所对应的酸都比盐酸弱,通入SO2与CO2都不会生成沉淀,故⑤选;
⑥H2S与二氧化硫反应生成硫沉淀,故⑥不选;
⑦通入NH3溶液呈碱性,溶液中生成大量的SO32﹣离子,生成沉淀BaSO3,故⑦不选;
⑧NaClO溶液具有氧化性,将SO2氧化为SO42﹣离子,生成沉淀BaSO4,故⑧不选;故答案为:③⑤;
(2)a.若A是非金属单质,则C与水反应的生成物可能是强酸或弱酸,如A是碳单质,X为氧气,B为CO、C为CO2,二氧化碳和水反应生成碳酸为弱酸,如A为S,X为氧气,B为SO2,C为SO3,三氧化硫与水反应生成硫酸为强酸,故a正确;
b.若A是金属单质,则C与水反应的生成物可能是强碱,如A是钠,X为氧气,B为氧化钠,C为过氧化钠,过氧化钠和水反应生成氢氧化钠,故b正确;
c.若A是化合物,则C与水反应的生成物可能是强酸,如A是氨气,X为氧气,B为NO,C为NO2,二氧化氮和水反应生成硝酸为强酸,故c正确,故选:abc;
(2)①有的离子反应只表示一个化学反应,比如:2Na+2H2O=2Na++2OH﹣+H2↑,
②H++OH﹣=H2O只表示强酸和强碱反应生成可溶性的盐和水的反应,有的酸碱反应不能表示为H++OH﹣=H2O,比如硫酸和氢氧化钡之间的反应:2H++SO42﹣+Ba2++2OH﹣=BaSO4↓+2H2O,


科目:高中化学 来源: 题型:
【题目】如图,a、b是石墨电极,通电一段时间后,b极附近溶液显红色。下列说法正确的是

A. X极是电源负极,Y极是电源正极
B. 电解过程中CuSO4溶液的pH逐渐增大
C. a极的电极反应是2Cl--2e-=Cl2↑
D. Pt极上有6.4 g Cu析出时,b极产生2.24 L(标准状况)气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A. 液溴易挥发,在存放液溴的试剂瓶中应加水封
B. 能使润湿的淀粉KI试纸变成蓝色的物质一定是Cl2
C. 某溶液加入CCl4,CCl4层显紫色,证明原溶液中存在I-
D. 某溶液加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液一定含有Ag+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤是重要能源。燃煤会释放SO2、CO等有毒气体。消除有毒气体的研究和实践从未停止。完成下列填空:
I.用CaSO4消除CO。CaSO4和CO可发生如下两个反应:
反应①:CaSO4(s)+4CO(g)![]() CaS(s)+4CO2(g)+175.6kJ
CaS(s)+4CO2(g)+175.6kJ
反应②:CaSO4(s)+4CO(g)![]() CaO(s)+SO2(g)+CO2(g)—218.4kJ
CaO(s)+SO2(g)+CO2(g)—218.4kJ
(1)写出反应①的平衡常数表达式:_____________;一定条件下的密闭容器中,两反应均达平衡后,若使反应①K的减小,需要改变的反应条件是______________,则反应②的K___________(选填编号)、反应①的v(CO2)正__________(选填编号)。
a. 增大 b. 减小 c. 不变 d. 无法判断
(2)补全下图中反应②的能量变化示意图_______________(即,注明生成物能量的大致位置及反应热效应数值)

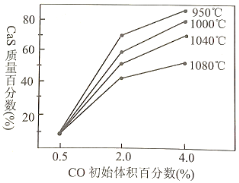
(3)下图是不同温度下,CO初始体积百分数与平衡时固体产物中CaS质量百分数的关系曲线。写出两种降低SO2生成量的措施___________________________________。
II. Fe2(SO4)3溶液可除去煤中以黄铁矿(FeS2)形式存在的硫元素,反应如下:8H2O + FeS2+ 7Fe2(SO4)3→15FeSO4+ 8H2SO4
(4)标出电子转移的数目和方向________;还原产物是_______。
(5)检验上述反应中Fe2(SO4)3是否消耗完的实验方案:___________________________。
(6)该方法的优点之一是Fe2(SO4)3易再生。向反应后的溶液中通入___________,就能达到使Fe2(SO4)3再生的目的,方便且价廉。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中有丰富的资源,下图为海水利用的部分过程。下列有关说法正确的是

A. 由反应①可知:相同温度下,NaHCO3的溶解度大于Na2CO3
B. 通过电解MgCl2·6H2O晶体可以获得Mg单质
C. 反应②的离子方程式为:Br2+SO2+2H2O=SO42-+2Br—+4H+
D. 粗盐中含有的Mg2+、SO42-等杂质离子,可通过依次加入BaCl2溶液、NaOH溶液、盐酸等试剂加以去除
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于热化学反应的描述中正确的是
A. 需要加热才能发生的反应一定是吸热反应
B. CO(g)的燃烧热ΔH=-283.0 kJ/mol,则2CO2(g)===2CO(g)+O2(g)反应的ΔH=+566.0 kJ/mol
C. HCl和NaOH反应的中和热ΔH=-57.3 kJ/mol,则H2SO4和Ba(OH)2反应的反应热ΔH=2×(-57.3) kJ/mol
D. 已知在120 ℃、101 kPa下,1 g H2燃烧生成水放出121 kJ热量,其热化学方程式为H2(g)+![]() O2(g)===H2O(l) ΔH=-242 kJ·mol-1
O2(g)===H2O(l) ΔH=-242 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
(1)CH3COOH(l)+2O2(g) == 2CO2(g)+2H2O(l) ΔH1=-870.3 kJ·mol-1
(2)C(s)+ O2(g) == CO2(g) △H2=-393.5 kJmol-1
(3)H2(g) +![]() O2(g) == H2O(l) △H3=-285.8kJ·mol-1
O2(g) == H2O(l) △H3=-285.8kJ·mol-1
则反应2C(s)+2H2(g) +O2(g) == CH3COOH(l)的△H为( )
A. -488.3 kJ·mol-1 B. -244.15 kJ·mol-1 C. +488.3 kJ·mol-1 D. +244.15 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是
A. 常温常压下,8g甲烷中含C-H键数目为0.4NA
B. 标准状况下,11.2LSO3中含分子数目为0.5NA
C. 1L0.1mol/LNH4NO3溶液中含氧原子数目为0.3NA
D. 7.8gNa2O2与足量CO2完全反应转移电子数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由单质A与化合物B两种粉末组成的混合物,在一定条件下可按如图所示发生转化:

请回答:
(1)A、B的化学式分别为________、________。
(2)反应①的化学方程式:_____________________________________________________。
(3)写出反应②③的离子方程式:
②________________________________________________________________________;
③________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com