
【题目】天然气水蒸汽重整法是工业上生产氢气的重要方法,反应在 400℃以上进行。l 00kPa 时,在反应容器中通入甲烷与为水蒸汽体积比为1 : 5的混合气体,发生下表反应。
反应方程式 | 焓变△H(kJ/mol) | 600℃时的平衡常数 |
①CH4(g)+ H2O(g) | a | 0.6 |
②CH4(g)+ 2H2O(g) | +165.0 | b |
③CO(g)+ H2O(g) | -41.2 | 2.2 |
请回答下列下列问题:
(1)上表中数据 a=__________; b= ___________ 。
(2)对于反应②,既能加快反应又能提高CH4转化率的措施是_____________。
A.升温 B.加催化剂 C.加压 D.吸收CO2
(3)下列情况能说明容器中各反应均达到平衡的是___________。
A.体系中H2O与CH4物质的量之比不再变化
B.体系中H2的体积分数保持不变
C.生成n 个CO2的同时消耗2n个H2O
D. v正(CO)= v逆(H2)
(4)工业重整制氢中,因副反应产生碳会影响催化效率,需要避免温度过高以减少积碳。该体系中产生碳的反应方程式为 _______________。
(5)平衡时升温,CO含量将_________(选填“增大”或“减小”)。
(6)一定温度下 ,平衡时测得体系中 CO2和H2的物质的量浓度分别是0.75mo l/L、4.80mol/L , 则此时体系中CO 物质的量浓度是_______ mol/L。
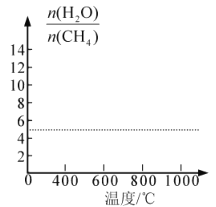
(7)改变上述平衡体系的温度,平衡时H2O与CH4物质的量之比[![]() ]值也会随着改变,在图中画出其变化趋势。________________
]值也会随着改变,在图中画出其变化趋势。________________
【答案】+206.2 1.32 A AB CH4 ![]() C+2H2 增大 0.6
C+2H2 增大 0.6 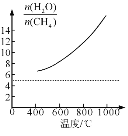
【解析】
⑴第②个方程式减去第③个方程式,方程式相减,平衡常数相除。
⑵根据影响反应速率和平衡移动的规律进行分析,但是要同时满足:既能加快反应又能提高CH4转化率;
⑶根据正逆反应速率相等,各组分的浓度保持不变及由此衍生的其他物理量进行分析;
⑷甲烷分解生成碳和氢气;
⑸平衡时升温,对反应①是平衡向吸热反应即正向移动,对反应③是平衡向吸热反应即逆向移动。
⑹根据得失电子守恒计算c(CO)平衡时浓度。
⑺反应容器中通入甲烷与为水蒸汽体积比为1 : 5的混合气体,当反应发生时H2O与CH4物质的量之比![]() ,开始改变上述平衡体系的温度,对①和②平衡向吸热反应移动即正向移动,对③平衡逆向移动,因此
,开始改变上述平衡体系的温度,对①和②平衡向吸热反应移动即正向移动,对③平衡逆向移动,因此![]() 增大。
增大。
⑴第②个方程式减去第③个方程式得到a = +165.0(41.2) =+ 206.2,方程式相减,平衡常数相除,因此![]() ,解得b =1.32;故答案为:+206.2;1.32。
,解得b =1.32;故答案为:+206.2;1.32。
⑵对于反应②,
A.反应是吸热反应,升温,速率加快,平衡正向移动,CH4转化率增大,故A符合题意;
B.加催化剂,加快反应速率,但平衡不移动,故B不符合题意;
C.加压,加快反应速率,但平衡向体积减小方向即逆向移动,CH4转化率减小,故C不符合题意;
D.吸收CO2,生成物浓度减小,反应速率减慢,故D不符合题意;
综上所述,答案为A。
⑶A.体系中H2O与CH4物质的量之比不再变化,则达到平衡,故A符合题意;
B.体系中H2的体积分数保持不变,则达到平衡,故B符合题意;
C.生成n 个CO2的同时消耗2n个H2O,都是正方向,同一个方向,不能说明达到平衡,故C不符合题意;
D.υ正(CO)= υ逆(H2),反应体系中CO与H2的比例不清楚,因此不能说明达到平衡,故D不符合题意;
综上所述,答案为AB。
⑷该体系中产生碳的反应主要是甲烷分解生成碳和氢气,其方程式为CH4 ![]() C+2H2;
C+2H2;
故答案为:CH4 ![]() C+2H2;
C+2H2;
⑸反应①是吸热反应,反应③是放热反应,平衡时升温,对反应①是平衡向吸热反应即正向移动,对反应③是平衡向吸热反应即逆向移动,因此CO含量将增大;
故答案为:增大。
⑹一定温度下 ,平衡时测得体系中 CO2和H2的物质的量浓度分别是0.75 molL1、4.80 molL1,根据得失电子守恒,CH4到CO2升高8价,CH4到CO升高6价,甲烷或水到H2降低2个价态,因此8×0.75 molL1 +6c(CO) =2×4.80 molL1,解得c(CO) =0.6 molL1;
故答案为:0.6;
⑺反应容器中通入甲烷与为水蒸汽体积比为1:5的混合气体,当反应发生时H2O与CH4物质的量之比![]() ,开始改变上述平衡体系的温度,对①和②平衡向吸热反应移动即正向移动,对③平衡逆向移动,因此
,开始改变上述平衡体系的温度,对①和②平衡向吸热反应移动即正向移动,对③平衡逆向移动,因此![]() 增大,在图中画出其变化趋势为
增大,在图中画出其变化趋势为 ;
;
故答案为: 。
。


科目:高中化学 来源: 题型:
【题目】下列各组物质既不属于同系物,也不属于同分异构体的是( )
A.CH3-CH2-CH3和CH3-CH2-CH2-CH3
B.CH3CH2CH=CH2和![]()
C.![]() 和
和![]()
D.乙酸和甲酸甲酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4HCO3的分解温度是 35℃。以氯化钾和制取二氧化钛的副产品硫酸亚铁为原料生产铁红颜料和过二硫酸铵等,原料的综合利用率较高。其主要流程如下:
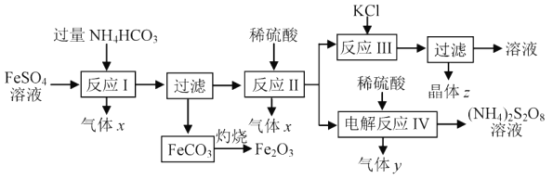
(1)气体x是_________,反应 I 需控制反应温度低于35℃ , 其目的是_______。
(2)反应I的离子方程式为 ___________,FeCO3灼烧的反应方程式为 __________。
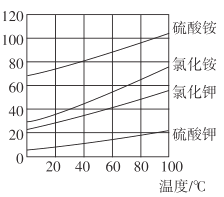
(3)各物质的溶解度曲线如图,晶体z是____,简述反应III发生的原因 ________,工业生产上常在反应III的过程中加入一定量的乙醇,其目的是_____________。
(4)反应IV 常用于生产(NH4)2S2O8 (过二硫酸铵)。电解时均用惰性电极,气体y是__________,阳极发生的电极反应可表示为_______________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列卤代烃在KOH醇溶液中加热不反应的是( )
①![]() ②
②![]() ③(CH3)3C—CHBr2 ④CHCl2—CHBr2 ⑤
③(CH3)3C—CHBr2 ④CHCl2—CHBr2 ⑤![]() ⑥CH3Cl
⑥CH3Cl
A. ①③⑥B. ②③⑤C. ②④D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaBH4燃料电池具有理论电压高、能量密度大等优点。以该燃料电池为电源电解精炼铜的装置如图所示。下列说法不正确的是( )
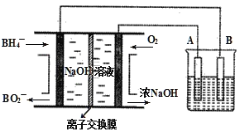
A.离子交换膜应为阳离子交换膜,Na+由左极室向右极室迁移
B.该燃料电池的负极反应式为BH4+8OH--8e-=BO2-+6H2O
C.电解池中的电解质溶液可以选择CuCl2溶液
D.每消耗2.24LO2(标准状况)时,A电极的质量减轻12.8g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,矩形OABC中,OA、OC分别在平面直角坐标系x轴、y轴的正半轴上,点D在AB上,将△CDB沿着CD翻折,点B恰好落在OA的中点E处,若四边形OCDA的面积为![]() ,则直线ED的解析式为( )
,则直线ED的解析式为( )
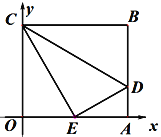
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物![]() 在医药合成中有着广泛的用途。下列有关该物质的说法正确的( )
在医药合成中有着广泛的用途。下列有关该物质的说法正确的( )
A.该化合物中含氧官能团为酯基
B.该化合物中的所有碳原子一定处于同一平面内
C.该化合物可发生取代反应、加成反应和氧化反应
D.该化合物的同分异构体中,苯环上有两个取代基的共3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是一种重要的化工产品。
(1)标准状况下,1 mol NH3的体积约为________L。
(2)实验室制取NH3的化学方程式为______________。
(3)收集NH3应使用________法,要得到干燥的NH3可选用___做干燥剂。
(4)压强对合成氨反应具有重要的影响。下表是反应达到平衡时压强与 NH3 含量的一些实验数据:
压强MPa | 10 | 20 | 30 | 60 | 100 |
NH3含量(体积分数%) | 81.5 | 86.4 | 89.9 | 95.4 | 98.8 |
从表中数据可以推断:随着压强增大,平衡时NH3含量随之___(填字母)。
A.增大 B.减小 C.先增大再减小 D.不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Calanolide A是一种抗HIV药物,其结构简式如下图所示。已知:碳原子上连有4个不同的原子或基团时,该碳称为手性碳。下列关于Calanolide A的说法不正确的是( )
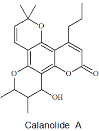
A.分子中有3个手性碳原子
B.分子中有5种含氧官能团
C.能发生消去反应、加成反应、氧化反应和还原反应
D.1molCalanolide A最多消耗2molNaOH或5molH2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com