
 水是组成生命体的重要化学物质,有关水的反应有很多.
水是组成生命体的重要化学物质,有关水的反应有很多.| 6.72 |
| 22.4 |
| 44.8 |
| m |
| 56 |
| 3 |
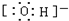 ,
,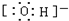 ;
;| 9.6×10-3g |
| 96g/mol |
| aL |
| 22.4L/mol |
| a |
| 22.4 |
| 17a |
| 22.4 |
| 17a |
| 22.4 |
1000+
| ||
| 1000b |
| 22400+17a |
| 22400b |
| ||
|
| 1000ab |
| 22400+17a |
| 1000ab |
| 22400+17a |
| 6.72 |
| 22.4 |
| 44.8 |
| m |
| 56 |
| 3 |
| 催化剂 |
| △ |
| 催化剂 |
| △ |


科目:高中化学 来源: 题型:
| A、某晶体固态不导电,水溶液能导电说明该晶体是离子晶体 |
| B、原子晶体的原子间只存在共价键,而分子晶体内只存在范德华力 |
| C、区分晶体和非晶体最科学的方法是对固体进行X-射线衍射实验 |
| D、任何晶体中,若含有阳离子也一定含有阴离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
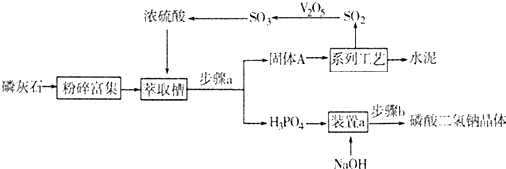
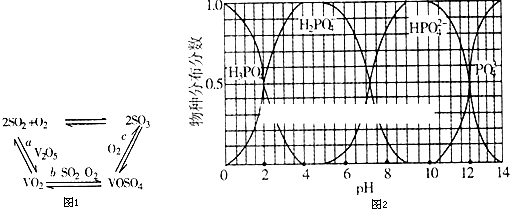
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol A和1molB |
| B、2molC |
| C、3mol A和3molB |
| D、1molB和2molC |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
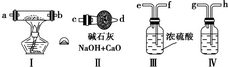
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com