
| A、1mol A和1molB |
| B、2molC |
| C、3mol A和3molB |
| D、1molB和2molC |


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案科目:高中化学 来源: 题型:
| A、主动运输 |
| B、渗透作用 |
| C、鳃部交换气体随血液循环 |
| D、水中食物链 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | 相关信息 |
| A | A单质能与冷水剧烈反应,得到强碱性溶液 |
| B | B原子最外层电子数是其内层电子数的三倍 |
| C | 在第三周期元素中,C的简单离子半径最小 |
| D | A、B、D组成的36电子的化合物X是家用消毒剂的主要成分 |
| E | 所有有机物中都含有E元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:


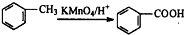
| 浓硫酸 |
| 浓硫酸 |
| 催化剂 |
| 390℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:
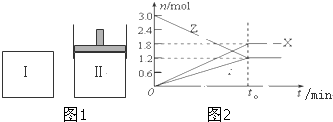
| A、该反应的化学方程式为:3X+2Y?2Z |
| B、若两容器中均达到平衡时,两容器的体积V(Ⅰ)<V(Ⅱ),则容器Ⅱ达到平衡所需时间大于t0 |
| C、两容器中均达到平衡时,Z的物质的量分数相同 |
| D、达平衡后,V(x)为1.8/t0 mol/(L?min) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 水是组成生命体的重要化学物质,有关水的反应有很多.
水是组成生命体的重要化学物质,有关水的反应有很多.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加适量的醋酸钠晶体后,两溶液的pH均增大 |
| B、加入足量的苏打固体充分反应后,两溶液中产生的CO2一样多 |
| C、加水稀释2倍后,两溶液的pH均减小 |
| D、加足量的锌充分反应后,盐酸中产生的氢气速率快 |
查看答案和解析>>
科目:高中化学 来源: 题型:
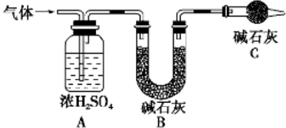 资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体并生成白色不溶物
资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体并生成白色不溶物| 实验序号 | 实验 | 实验现象 | 结论 |
| 实验Ⅰ | 取一小段镁条,用砂纸擦去表面氧化膜,将其放入含有酚酞的饱和碳酸氢钠溶液中,过滤 | 产生大量气泡和白色不溶物,溶液有浅红色变成红色 | |
| 实验Ⅱ | 将实验Ⅰ中收集到的气体点燃 | 能安静的燃烧,产生淡蓝色火焰 | ①气体成分为 |
| 实验Ⅲ | 取实验Ⅰ中白色不溶物,洗涤,加入足量稀盐酸 | ② | 白色不溶物中含有 MgCO3 |
| 实验Ⅳ | ③ | 产生白色沉淀 | 溶液中存在CO32- |
| x |
| y |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com